
分析 ①由反应方程式可知生成1mol的CH3OH时放热91 kJ,想得到182kJ热量,则需生成2molCH3OH;由于反应是可逆反应,不可能完全进行到底,所以要得到2molCH3OH,CO与H2物质的量必须要多于2mol和4mol;
②已知反应:CO(g)+2H2(g)?CH3OH(g)△H=-91kJ/mo1,则有CH3OH(g)?CO(g)+2H2(g);△H=+91KJ•mol-1,保持恒温恒压,将1mol CO和2mol H2充入一密闭容器中与起始时在该容器中充入1mol CH3OH(g),为等效平衡状态,平衡时两种不同的途径平衡状态相同,各物质的含量、物质的量等都相同,以此计算.
解答 解:①由反应方程式可知生成1mol的CH3OH时放热91 kJ,想得到182kJ热量,则需生成2molCH3OH;由于反应是可逆反应,不可能完全进行到底,所以要得到2molCH3OH,CO与H2物质的量必须要多于2mol和4mol,
故答案为:D;
②CO(g)+2H2(g)?CH3OH(g)△H=-91kJ/mo1
起始量 1 2 0
转化量0.2 0.4 0.2
平衡量0.8 1.6 0.2
CH3OH(g)?CO(g)+2H2(g)△H=+91KJ•mol-1,
起始量 1 0 0
转化量 0.8 0.8 1.6
转化量 0.2 0.8 1.6
生成1molCH3OH放热91KJ,分解1molCH3OH吸热91KJ,分解0.8mol甲醇,吸热72.8KJ,
故答案为:吸收;72.8.
点评 本题考查了等效平衡的应用、逆反应的反应热,题目难度中等,抓住基础是关键.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:解答题
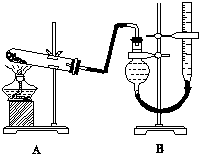 某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:| 实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
| ④ | 1.2g | 无其他物质 | |
| ⑤[ | 1.2g | CuO 0.5g | |
| ⑥ | 1.2g | MnO2 0.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 选项 | a中的物质 | b中的物质 | c中的物质 | d中的物质 | d中的物质 |
| A | 浓硫酸 | 铜片 | 品红溶液 | 酸性高锰酸钾溶液 | c,d中溶液颜色均褪色,依次体现SO2漂白性和还原性 |
| B | 浓硫酸 | 蔗糖 | 紫色石蕊溶液 | NaOH溶液 | c中溶液变红色,不能判断是SO2的作用 |
| C | 稀硝酸 | Cu | 收集NO2 | H2O | d中反应每消耗3mol氧化剂,转移2mol电子 |
| D | 浓氨水 | 碱石灰 | 收集NH3 | 稀H2SO4 | d中反应产物可作肥料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
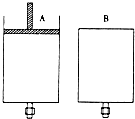 有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两只容器中分别充入等量的体积比为2:1的SO2与O2的混合气体,并使A和B容积相等(如图).在保持400℃的条件下使之发生如下反应:
有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两只容器中分别充入等量的体积比为2:1的SO2与O2的混合气体,并使A和B容积相等(如图).在保持400℃的条件下使之发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、MnO4-、K+、NO3-SO32- | B. | Na+、S2-、SO32-、H+、NO3- | ||
| C. | Na+、S2-、OH-、K+、Cl- | D. | HCO3-、H+、Na+、Ca2+ SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为:2MnO2+2H2O+2e-═2MnOOH+2OH- | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过0.2mol 电子,锌的质量理论上减少6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于有气体参与的反应,增大压强,活化分子总数增多,化学反应速率增大 | |
| B. | 对放热反应而言,升高温度,活化分子百分数减少,化学反应速率减小 | |
| C. | 活化分子间发生的碰撞为有效碰撞 | |
| D. | 使用催化剂,活化分子百分数增多,化学反应速率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com