
氢气是一种新型的绿色能源,又是一种重要的化工原料.
合成氨反应的热化方程式如下:
N2(g)+3H2(g)⇌2NH3(g);△H=﹣92.4kJ/mol
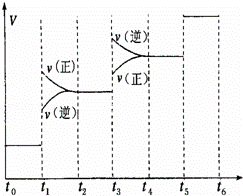
(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.
图中t1时引起平衡移动的条件可能是 ,
其中表示平衡混合物中NH3的含量最高的一段时间是 ,若t0﹣t1,t1﹣t3,t3﹣t5这三段平衡常数分别用K1,K2,K3表示,那么K1,K2,K3的大小关系是
(2)若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂反应的△H (填“增大”、“减小”或“不改变”).
(3)温度为T℃时,将2a mol H2和 a mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则反应的平衡常数为 .
考点:
化学反应速率变化曲线及其应用;化学平衡的影响因素.
专题:
化学平衡专题.
分析:
(1)根据图象分析影响平衡的因素,平衡常数随温度而变化;
(2)依据影响平衡的因素分析判断平衡移动;
(3)计算出平衡时各物质的浓度,根据平衡常数表达式计算化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比
解答:
(1)N2(g)+3H2(g)⇌2NH3(g);△H=﹣92.4kJ/mol;反应是放热反应,反应前后气体体积减小,依据反应速率与时间的关系图象分析,t1时正逆反应速率都增大,平衡正向移动,引起平衡移动的条件可能是增大压强;表示平衡混合物中NH3的含量最高的一段时间是t2﹣t3;若t0﹣t1,t1﹣t3,t3﹣t5这三段平衡常数分别用K1,K2,K3表示,平衡常数随温度变化,升高温度平衡左移,平衡常数减小,那么K1,K2,K3的大小关系是:K1=K2>K3,
故答案为:增大压强;t2﹣t3;K1=K2>K3;
(2)若在恒温、恒压条件下向平衡体系中通入氩气,为保持恒压,体积增大,平衡向逆向进行;催化剂改变反应速率,不改变化学平衡,反应焓变不变,故答案为:向左;不改变;
(3)温度为T℃时,将2a mol H2和 a mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则反应的平衡常数可以列出三段式计算平衡浓度,依据平衡常数概念计算:
N2(g)+3H2(g)⇌2NH2(g)
开始 2amol/L 4amol/L 0
反应 amol/L 3amol/L 2amol/L
平衡 amol/L amol/L 2amol/L
所以化学平衡常数K=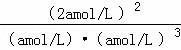 =
=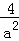 (mol/L)﹣2;
(mol/L)﹣2;
故答案为: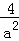 (mol/L)﹣2;
(mol/L)﹣2;
点评:
本题考查了反应热、影响化学反应速率的因素,图象分析,化学平衡三段式计算等知识点,中等难度.


科目:高中化学 来源:2014-2015学年河北省高三下学期期中考试理综化学试卷(解析版) 题型:简答题
【化学选修2-化学与技术】(15分)以硼镁矿(2Mg·B2O3·H2O·SiO2 )及少量Fe3O4、CaCO3 、Al2O3 )为原料生产硼酸的工艺流程如下:
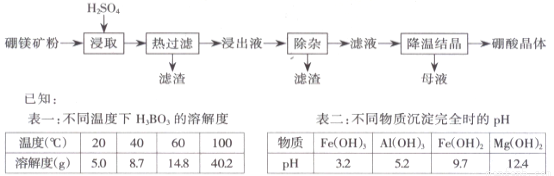
(1)由于矿粉中含CaCO3 ,“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施为_____。
(2)“浸出液”显酸性,含有H3BO3、Mg2+和SO42 -,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时,向浸出液中依次加入适量目H2O2和MgO,可以除去的杂质离子为_________,H2O2 的作用为_________(用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的为_______。
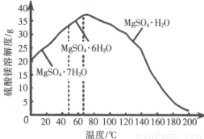
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图所示,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收 MgSO4.H2O,应采取的措施是将“母液”蒸发浓缩,____。
(5)已知25 ℃时,硼酸( H3BO3)溶液中存在如下平衡:
H3BO3(aq)+H2O(l) [B(OH)4]-(aq)+H+(aq) K=5.7×10-10;
[B(OH)4]-(aq)+H+(aq) K=5.7×10-10;
25 ℃时,0.7 mol·L-1硼酸溶液中c(H+)≈ mol·L-1.
(6)已知25 ℃时:
化学式 | H2CO3 | CH3COOH |
电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
下列说法正确的是_____________(填选项字母)。
A.碳酸钠溶液滴入硼酸溶液中能观察到有气泡产生
B.碳酸钠溶液滴入醋酸溶液中能观察到有气泡产生
C.等浓度碳酸溶液和硼酸溶液的pH:前者>后者
D.等浓度碳酸钠溶液和醋酸钠溶液的pH:前者>后者
查看答案和解析>>
科目:高中化学 来源: 题型:
要鉴别己烯中是否混有少量甲苯,正确的实验方法是( )
|
| A. | 先加足量的酸性高锰酸钾溶液,然后再加入溴水 |
|
| B. | 先加足量溴水,然后再加入酸性高锰酸钾溶液 |
|
| C. | 点燃这种液体,然后再观察火焰的颜色 |
|
| D. | 加入浓硫酸与浓硝酸后加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g) 正反应是放热反应.若反应物起始的物质的量相等,下列关于该反应的示意图不正确的是( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,往a、b两容器中各注入1mol三氧化硫,a、b两容器起始体积和压强均相同,分别保持恒容和恒压,发生以下反应:2SO3(g) 2SO2(g)+O2(g)两容器中三氧化硫物质的量随时间(t)变化的示意图为( )
2SO2(g)+O2(g)两容器中三氧化硫物质的量随时间(t)变化的示意图为( )
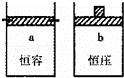
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 中和热一定是强酸跟强碱反应放出的热量
B. 1 mol酸与1 mol碱完全反应放出的热量是中和热
C. 在稀溶液中,酸与碱发生中和反应生成1 mol H2O(L)时的反应热叫做中和热
D. 表示中和热的离子方程式为:H++OH﹣═H2O△H=﹣57.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:Fe2O3(s)+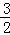 C(s)═
C(s)═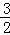 CO2(g)+2Fe(s)△H=+234.1kJ/mol
CO2(g)+2Fe(s)△H=+234.1kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
则:2Fe(s)+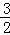 O2(g)═Fe2O3(s)的△H是()
O2(g)═Fe2O3(s)的△H是()
A. ﹣824.4 kJ/mol B. ﹣627.6 kJ/mol
C. ﹣744.7 kJ/mol D. ﹣169.4 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
以下物质间的转化通过一步反应不能实现的是()
A. HCl→Cl2→HClO→NaClO B. Na→Na2O2→Na2CO3→NaHCO3
C. Si→SiO2→H2SiO3→Na2SiO3 D. Al→NaAlO2→Al(OH)3→Al2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com