
| 0.02mol |
| 0.2L |
| 10-13 |
| 0.1 |


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
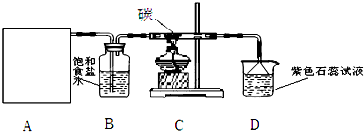
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ/mol,反应物总能量<生成物总能量 |
| B、相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子的能量为E2,则2E1>E2 |
| C、101 kPa时,2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,H2的燃烧热△H=-241.8 kJ/mol |
| D、H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,含1 mol NaOH的氢氧化钠溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ 的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、打开汽水瓶有气泡从溶液中冒出 |
| B、实验室用排饱和食盐水法收集氯气 |
| C、合成氨工厂采用增大压强以提高原料的转化率 |
| D、2NO2(g)═N2O4(g)的平衡体系中,加压缩小体积后颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝片与稀盐酸的反应 |
| B、Ba(OH)2?8H2O与NH4Cl的反应 |
| C、灼热的碳与二氧化碳的反应 |
| D、酒精在空气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10ml质量分数为98%的H2SO4,用10ml水稀释后,H2SO4的质量分数大于49% |
| B、配制0.1mol/L的Na2CO3溶液480ml,需用500ml容量瓶 |
| C、在标况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水 |
| D、向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用食醋清洗热水瓶中的水垢;用米汤检验碘盐中含有碘酸钾 |
| B、用小苏打可中和胃酸,热纯碱溶液可除油污.小苏打和纯碱可以用石灰水鉴别 |
| C、“84消毒液”和洁厕剂能同时使用,除污垢效果好 |
| D、用丁达尔效应区别鸡蛋白溶液和食盐水;用明矾可以净水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com