
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为_______。利用反应6NO2+8NH3![]() 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=﹣196.6 kJmol-1
2SO3(g) ΔH1=﹣196.6 kJmol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH2=﹣113.0kJmol-1
2NO2(g) ΔH2=﹣113.0kJmol-1
则反应NO2(g)+ SO2(g)![]() SO3(g)+NO(g)的ΔH=________kJmol-1。
SO3(g)+NO(g)的ΔH=________kJmol-1。
一定条件下,将2molNO2与2molSO2置于容积固定的恒温密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________(填字母)
a.混合气体密度保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1molSO3的同时生成1molNO2
该反应达平衡状态后,若再向该容器充入1molNO2与1molSO2,则SO2的转化率将_______(填“增大”“减小”或“不变”)。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=﹣a kJmol-1。在一定温度下,将1molCO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则v(CH3OH)为_______,正反应放出的热量为______。
CH3OH(g) ΔH=﹣a kJmol-1。在一定温度下,将1molCO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则v(CH3OH)为_______,正反应放出的热量为______。
(4)已知N2O4(g)![]() 2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图能说明反应达到平衡状态的是_______。
2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图能说明反应达到平衡状态的是_______。
A.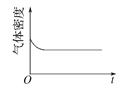 B.
B.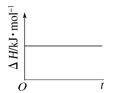 C.
C. D.
D.
【答案】3NO2+H2O=2HNO3+NO 6.72 -41.8 b 不变 0.006mol/(L·min) 0.3akJ ACD
【解析】
(1)NO2与水反应生成硝酸和NO完成方程式的书写;根据方程式及转移电子数目计算NO2;
(2)根据盖斯定律计算焓变;根据平衡状态的特征判断;根据勒夏特列原理找等效平衡即可;
(3)同一密闭容器中压强之比等于物质的量之比,计算平衡后的总物质的量,再用三段式求解;
(4)根据平衡状态的特征判断。
(1)NO2与水反应生成硝酸和NO,方程式为3NO2+H2O=2HNO3+NO;根据方程式可知,6molNO2参与反应,化合价由+4变为0,得到24mol电子,转移1.2mol电子时,消耗的NO2的物质的量为0.3mol,标况下的体积为6.72L;
(2)已知①2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=﹣196.6 kJmol-1
2SO3(g) ΔH1=﹣196.6 kJmol-1
②2NO(g)+O2(g)![]() 2NO2(g) ΔH2=﹣113.0kJmol-1
2NO2(g) ΔH2=﹣113.0kJmol-1
根据盖斯定律,(①-②)/2即可得到NO2(g)+ SO2(g)![]() SO3(g)+NO(g),则ΔH=(-196.6+113.0)kJ/mol/2=-41.8kJ/mol;
SO3(g)+NO(g),则ΔH=(-196.6+113.0)kJ/mol/2=-41.8kJ/mol;
a.反应体系中,各物质均为气体,则气体的质量不变,且体积恒定,则混合气体密度保持不变,则密度不能判断是否达到平衡的依据,a错误;
b.NO2显红棕色,反应达到平衡时,NO2的浓度不再改变,则混合气体颜色保持不变,b正确;
c.反应中SO3和NO的体积比自始至终保持不变,不能判断是否达到平衡状态,c错误;
d.每消耗1molSO3必然生产1molNO2,不能判断是否达到平衡状态,d错误;
答案为b;
反应体系中,可逆号两边气体计量数的和相等,反应平衡后再加入1molNO2与1molSO2,相当于增大压强体积减小,平衡不移动,SO2的转化率不变;
(3)同一密闭容器中压强之比等于物质的量之比,则3:n=1:0.8,n=2.4mol;
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
初:1 2 0
反:x 2x x
平:1-x 2-2x x
则3-2x=2.4mol,x=0.3mol,v(CH3OH)=0.3mol/(10L×5min)=0.006mol/(L·min);0.3molCO参与反应释放的热量为0.3akJ;
(4)A.反应体系中,左右两边气体计量数的和不相等,容积为恒压,则平衡时气体的物质的量不变,体积不再改变,气体质量一直未变,密度也不变,则平衡时密度不再改变,A正确;
B.该反应的焓变与平衡与否无关,则焓变不能判断是否达到平衡状态,B错误;
C.反应达到平衡时,各物质的物质的量不再改变,图像中t1时各量不再变化,则达到平衡状态,C正确;
D.反应达到平衡时,各物质的物质的量不再改变,则N2O4的转化率不再改变,D正确;
答案为ACD。


科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
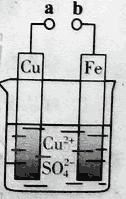
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】作为“血迹检测小王子”,鲁米诺反应在刑侦中扮演了重要的角色,其一种合成原理如图所示。下列有关说法正确的是
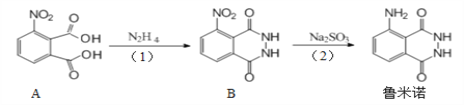
A. 鲁米诺的化学式为C8H6N3O2
B. 1 mol A分子最多可以与5 mol氢气发生加成反应
C. B中处于同一平面的原子有9个
D. (1)、(2)两步的反应类型分别为取代反应和还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.5mol/(L·min)B.v(D)=1mol/(L·min)
C.v(C)=0.8mol/(L·min)D.v(B)=0.3mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)=CO2(g);ΔH1=-393.15kJ·mol-1 ①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g) +H2(g);ΔH2 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g);ΔH3=-566kJ·mol-1 ③
2H2(g)+O2(g)=2H2O(g);ΔH4=-484kJ·mol-1 ④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上_______(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH2=______。
(3)煤燃烧的烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减 少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为NO(g)+O3(g)=NO2(g)+O2(g) ΔH1=-200.9kJ·mol-1,NO(g)+![]() O2(g)=NO2(g) ΔH2=-58.2kJ·mol-1,SO2(g)+O3(g)=SO3(g)+O2(g) ΔH3=-241.6kJ·mol-1,则反应3NO(g)+O3(g)=3NO2(g)的ΔH=________。
O2(g)=NO2(g) ΔH2=-58.2kJ·mol-1,SO2(g)+O3(g)=SO3(g)+O2(g) ΔH3=-241.6kJ·mol-1,则反应3NO(g)+O3(g)=3NO2(g)的ΔH=________。
(4)在标准状况下的11.2L甲烷完全燃烧生成CO2和液态水放出444.8kJ热量(298K),能表示其燃烧热的热化学方程式是________;已知断裂1mol下列化学键需要吸收的能量分别为:C=O:745kJ;O=O键:496kJ;C-H键:414kJ,则断裂1molH-O键需要吸收的能量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝合金中含有元素铝、镁、铜、硅,为了测定该合金中铝的含量,设计了如下实验,请回答有关问题:
(1)称取样品a g(精确到0.1 g),称量时通常使用的主要仪器的名称是_____。
(2)将样品溶解于过量的稀盐酸,过滤并洗涤滤渣。滤液中主要含有________,滤渣为________,溶解、过滤用到的玻璃仪器是________。
(3)向滤液中加过量的氢氧化钠溶液,过滤并洗涤滤渣。有关的离子方程式是________________________________________________________________。
(4)向步骤(3)的滤液中通入足量的二氧化碳气体,过滤并洗涤滤渣。有关的离子方程式是______________________________________________________________。
(5)将步骤(4)中所得的滤渣烘干并灼烧至恒重、冷却后称量,其质量为b g。有关反应的化学方程式是
_______________________________________________________________________,原样品中铝的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组的同学用如图所示的装置探究二氧化碳的性质后,觉得探究很有意思,想继续探究:
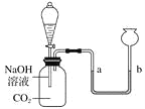
[提出问题]反应后溶液中的溶质有什么?
[查阅资料]
(1)氢氧化钠与二氧化碳反应的化学方程式为___________。
(2)在上述反应中,若二氧化碳过量,能发生如下反应:Na2CO3+H2O+CO2=2NaHCO3。
(3) 2NaHCO3![]() Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。
[猜想与假设]通过分析,小明做出如下猜想:①含有氢氧化钠和碳酸钠;②含有碳酸钠和碳酸氢钠。
[实验探究]为确定反应后溶液的组成,同学进行了如下两项探究活动:
(1) 对相关物质性质的研究:
碳酸氢钠溶液 | 氢氧化钠溶液 | 碳酸钠溶液 | |
加入稀盐酸 | 产生气泡 | 无明显变化 | 产生气泡 |
加入饱和石灰水 | 溶液变浑浊 | 溶液变浑浊 | 现象Ⅰ |
加入氯化钙溶液 | 无明显变化 | 溶液变浑浊 | 溶液变浑浊 |
加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 | 澄清石灰水无明显变化 |
上表中现象Ⅰ对应的化学方程式为__________________。
(2)探究反应后溶液的成分:为确认反应后溶液的组成,小明设计了如下实验过程
实验步骤 | 操作 | 实验现象 | 实验结论 |
① | 取一定量反应后溶液放入试管中,滴加适量的氯化钙溶液 | 有沉淀产生 | —— |
② | 将步骤①所得的混合物过滤、洗涤,并将滤渣分成两部分 | —— | —— |
③ | 向其中一份步骤②所得固体中滴加稀盐酸 | 有气泡产生 | 原溶液中含有______ |
④ | 取另一份步骤②所得固体,_____ | _____ | _____ |
[反思与评价]
(1)若想直接证明小明的另一个猜想不正确,在上述方案的基础上,应加做的实验是_______。
(2)小伟提出,小明的猜想不完全,反应后溶液的组成还可能是_______(有几种写几种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在科研、生活等方面有广泛用途。如图所示为从海带中制取碘的工艺流程。

已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
请回答下列问题:
(1)分液漏斗使用前需要检漏,检漏方法为__________。
(2)步骤X中,萃取后分液漏斗内观察到的现象是_____________。
(3)下列有关步骤Y的说法中正确的是_____(填字母)。
A.应控制NaOH溶液的浓度和体积
B.将碘单质转化成碘离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以用乙醇代替
(4)向“上层”中加入H2SO4溶液,发生反应的化学方程式为____,操作Z的名称为________。
(5)方案甲中采用蒸馏不合理,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于燃烧热的描述中正确的是( )
A. 已知a g乙烯气体充分燃烧时生成1 mol CO2和液态水,放出b kJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)=4CO2(g)+4H2O(l) ΔH=-4b kJ·mol-1
B. 将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
C. H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. 葡萄糖的燃烧热是2800kJ·mol-1,则![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com