
����Ŀ��W��X��Y��ZΪԭ���������������ǰ������Ԫ�أ�Ԫ��W����������ḻ��Ԫ�أ�Ԫ��X��ԭ�ӵ����������������ڲ��������3����Ԫ��Z�Ļ�̬ԭ�Ӻ��������24���˶�״̬��Y��X��Z����ͬһ���ڣ���Ԫ��Y�Ļ�̬ԭ�Ӻ���p���ӱ�s���Ӷ�5����
(1)Z�Ļ�̬ԭ�ӵĺ�������Ų�ʽΪ____________________��
(2)Z����������ʯ�ͻ�������Ҫ�Ĵ���֮һ���ɴ�������ѻ����ɱ��ͱ�ϩ
��1 mol��ϩ�����к���![]() ����
����![]() ����Ŀ֮��Ϊ__________________��
����Ŀ֮��Ϊ__________________��
�ڱ�������̼ԭ�ӵ��ӻ�����Ϊ_________________��
��Z��һ��������ZO5�У�Z�Ļ��ϼ�Ϊ+6�������й���������ĿΪ______________��
(3)W��X��Y����Ԫ�صĵ縺����С�����˳��Ϊ_________________����Ԫ�ط��ű�ʾ����
(4)ZY3���۵�Ϊ1152�棬��������״̬���ܹ����磬�ݴ˿��ж�ZY3��������____________��������ͣ���
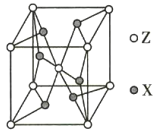
(5)ZX2����ľ����ṹ��ͼ��ʾ�����û��������Է�������ΪM�������߳�Ϊa pm�������ӵ�������ֵΪNA����þ�����ܶ�Ϊ_________ g/cm3��
���𰸡�[Ar]3d54s1��1s22s22p63s23p63d54s1 8��1 sp2�ӻ� 2 H��Cl��O ���Ӿ��� ![]() ��1030
��1030
��������
W��X��Y��ZΪԭ���������������ǰ������Ԫ�أ�Ԫ��W����������ḻ��Ԫ�أ�WΪH��Ԫ��X��ԭ�����������������ڲ��3����X����2�����Ӳ㣬���ϵ����Ų����ɣ���������Ų�Ϊ2��6����XΪO��Ԫ��Z�Ļ�̬ԭ�Ӻ��������24���˶�״̬��ZΪCr��Y��X��Z����ͬһ���ڣ���Yԭ�Ӻ���p���ӱ�s���Ӷ�5����Yλ�ڵ������ڣ�3p����5�����ӣ���YΪCl���Դ������
���������Ϣ�ƶϣ�WΪH��XΪO��YΪCl��ZΪCrԪ�ء�
(1)Cr��24��Ԫ�أ����ݹ���ԭ������֪Cr�Ļ�̬ԭ�ӵĺ�������Ų�ʽΪ[Ar]3d54s1��1s22s22p63S23p63d54s1��
(2)�ٱ�ϩ�ṹ��ʽΪCH2=CH-CH3�������еĵ�������������˫������1��������1������������1����ϩ�����к���8��������1��������1 mol��ϩ�����к���������������Ŀ֮��Ϊ8��1��
�ڱ����ӽṹ��ʽΪ��![]() ������ʽ��C6H6��������ÿ��̼ԭ���γ�3�������������µ��Ӷԣ��ʱ�������̼ԭ�ӵ��ӻ�����Ϊsp2�ӻ���
������ʽ��C6H6��������ÿ��̼ԭ���γ�3�������������µ��Ӷԣ��ʱ�������̼ԭ�ӵ��ӻ�����Ϊsp2�ӻ���
��Z��һ��������ZO5(CrO5)�У������������ĿΪx����-2����ԭ�ӵĸ�����5-2x��Cr�Ļ��ϼ�Ϊ+6������ݻ��������������ϼ۴�����Ϊ0��֪��2x+(5-2x)��2=6�����x=2�������������ĿΪ2��
(3)WΪH��XΪO��YΪCl��Ԫ�صķǽ�����O��Cl��H��Ԫ�صķǽ�����Խǿ����縺��Խ����W��X��Y����Ԫ�صĵ縺����С�����˳��ΪH��Cl��O��
(4)ZY3���۵�Ϊ1152�棬��������״̬���ܹ����磬�ݴ˿��ж�ZY3�����������Ӿ��壻
(5)�þ���ΪCrO2����ͼ��֪Crλ�ھ�������������ڣ�Oԭ��λ�����Ϻ����ڣ��þ����к���Crԭ����Ϊ1+8��![]() =2������Oԭ����Ϊ4��
=2������Oԭ����Ϊ4��![]() +2=4��һ�������к���2��Cr��4��Oԭ�ӣ�����2��CrO2�����û��������Է�������ΪM�������ܶ���=
+2=4��һ�������к���2��Cr��4��Oԭ�ӣ�����2��CrO2�����û��������Է�������ΪM�������ܶ���=![]() g/cm3=
g/cm3=![]() ��1030 g/cm3��
��1030 g/cm3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҷ�˹�Ͱ��������о�1��3-����ϩ������ʱ�������·�Ӧ��
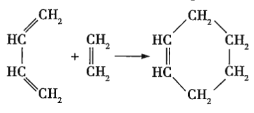 (Ҳ�ɱ�ʾΪ��
(Ҳ�ɱ�ʾΪ��![]() )
)
�ش��������⣺
(1)�Ҷ�˹-�����·�Ӧ����______(�Ӧ����)��
(2)���в��ܷ����Ҷ�˹-�����·�Ӧ���л�����________(�����)��
a.![]() b.
b.![]() c.
c.![]() d.
d.![]()
(3)��ҵ��ͨ���Լ�ȩ����ȲΪԭ����ȡ1��3-����ϩ�������������£�
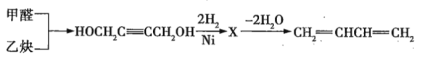
��X�Ľṹ��ʽΪ_________________��
��Xת����1��3-����ϩ�Ļ�ѧ����ʽΪ_______________________��
(4)��Ԫ�ұ���һ�ֵ���M�ļ���ʽΪ![]() �����ķ���ʽΪ________�������й�����˵������ȷ����_____________________(�����)��
�����ķ���ʽΪ________�������й�����˵������ȷ����_____________________(�����)��
A.�ڴ��������£�![]() ����������
����������![]() B.��ʹ����
B.��ʹ����![]() ��Һ��ɫ
��Һ��ɫ
C.����ʹ���![]() ��Һ��ɫ D.�����к���2������̼ԭ��
��Һ��ɫ D.�����к���2������̼ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20.00 mL 0.100 0 molL��1 (NH4)2SO4��Һ����μ���0.200 0 molL��1 NaOH��Һʱ����Һ��pH������NaOH��Һ����Ĺ�ϵ��ͼ��ʾ(�����ǻӷ�)������˵����ȷ����
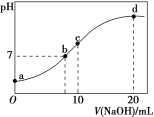
A. ��a��ʾ��Һ�У�c(NH4+)��c(SO42-)��c(OH��)��c(H��)
B. ��b��ʾ��Һ�У�c(NH4+)��c(Na��)��c(H��)��c(OH��)
C. ��c��ʾ��Һ�У�c(SO42-)��c(H��)��c(NH3��H2O)��c(OH��)
D. ��d��ʾ��Һ�У�c(SO42-)��c(NH3��H2O)��c(OH��)��c(NH4+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�����ӵ����ʵ���Ũ�ȹ�ϵ��ȷ���ǣ�������
A.NaH2PO4��ҺpH��7��������Һ�У� c��Na������c��H2PO4-����c��H3PO4����c��HPO42-��
B.0.1 mol��L��1��NH4��2SO4��Һ��0.1 mol��L��1NH3��H2O��Һ�������ϣ�c��NH4+����c��H������2c��SO42-����c��OH����
C.0.1 mol��L��1CH3COONa��Һ��0.1 mol��L��1CH3COOH��Һ�������ϣ�pH��7����c��CH3COOH����c��Na������c��CH3COO������c��H����
D.0.2 mol��L��1NaHCO3��Һ��0.1 mol��L��1Na2CO3��Һ�������ϣ� 2c��Na������3c��CO32-����3c��HCO3-����3c��H2CO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��LiAlH4���л��ϳ��г��õĻ�ԭ����LiAlH4�е������ӿռ乹����_________������ԭ�ӵ��ӻ���ʽΪ________��LiAlH4�У�����_________(���ţ���
a.���Ӽ� b.![]() �� c.
�� c.![]() �� d.���
�� d.���
��Li2O�����Ӿ��壬�侧���ܿ�ͨ����ͼ��Born�� Haberѭ������õ���
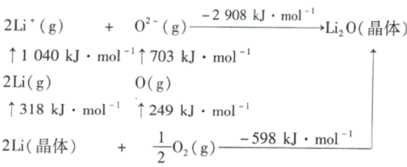
��֪��Liԭ�ӵĵ�һ������Ϊ_________kJ��mol-1��O=O������Ϊ__________ kJ��mol-1��Li2O������Ϊ_________ kJ��mol-1
��Li2O���з�өʯ�ṹ��������ͼ��ʾ����֪��������Ϊ0.465 nm�������ӵ�������ֵΪNA����Li2O���ܶ�Ϊ___________g��cm-3(�г�����ʽ)��
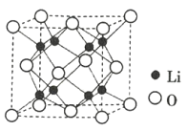
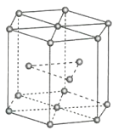
(2)����Zn�����е�ԭ�Ӷѻ���ʽ��ͼ��ʾ�����ֶѻ���ʽ��Ϊ_______���������ױ߱߳�Ϊa cm����Ϊc cm�������ӵ�������ֵΪNA��Zn���ܶ�Ϊ______ g��cm-3(�г�����ʽ)��
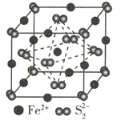
(3)FeS2����ľ�����ͼ��ʾ�������߳�Ϊa nm��FeS2���ʽ��ΪM�������ӵ�������ֵΪNA���侧���ܶȵļ������ʽΪ____________g��cm-3��������Fe2+λ��S22-���γɵ�������������ģ�����������ı߳�Ϊ____________nm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
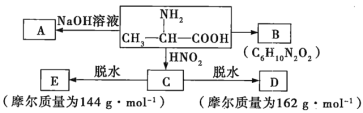
����Ŀ��M�ǵ�������Ԫ�أ������ֻ��1�����ӣ�����������ԭ�ӹ�����������ӡ�Ԫ��Y�ĸ�һ�����ӵ��������������������ͬ���ش��������⣺
��1������M�ľ�������Ϊ______��������ԭ�Ӽ�ͨ��_____�����γ����������ܶѻ�������Mԭ�ӵ���λ��Ϊ______��
��2��Ԫ��Y��̬ԭ�ӵĺ�������Ų�ʽΪ________����ͬ����Ԫ���У���һ������������______��дԪ�ط��ţ���Ԫ��Y�ĺ������У�������ǿ����________��д��ѧʽ������������ӵ����幹��Ϊ________��
��3��M��Y�γɵ�һ�ֻ����������������ͼ��ʾ��

�ٸû�����Ļ�ѧʽΪ_______����֪��������a=0.542 nm���˾�����ܶ�Ϊ_______g��cm�C3����д������ʽ����Ҫ��������������ӵ�����ΪNA��
�ڸû�����������ˮ�������ڰ�ˮ����ԭ����________���˻�����İ�ˮ��Һ��������������Ϊ����ɫ������ɫ��Һ�������ӵĻ�ѧʽΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪![]() ��������һ������������������
��������һ������������������![]() ��Ӧ�õ�
��Ӧ�õ�![]() �ǻ��ᣬ���£�
�ǻ��ᣬ���£�
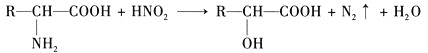
�Ը�����ͼ��ʾ��ϵ�ش������й����⡣
��1��д��A��B�Ľṹ��ʽ��A_________��B_________��
��2��![]() �Ļ�ѧ����ʽΪ________��
�Ļ�ѧ����ʽΪ________��
��3��![]() �Ļ�ѧ����ʽΪ________��
�Ļ�ѧ����ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�¶ȡ���ͬ�ݻ����ĸ��ܱ������н���ͬ���Ŀ��淴Ӧ��2X(g)+Y(g)![]() 3W(g)+2Z(g) ��H=��Q KJ/mol����ʼʱ������������ʵ�����ƽ��ʱ��ϵ�����仯�������������˵����ȷ���ǣ�������
3W(g)+2Z(g) ��H=��Q KJ/mol����ʼʱ������������ʵ�����ƽ��ʱ��ϵ�����仯�������������˵����ȷ���ǣ�������
X | Y | W | Z | ��Ӧ��ϵ�����仯 | |
�� | 2mol | 1mol | �ų�a kJ/mol | ||
�� | 1mol | 1mol | �ų�b kJ/mol | ||
�� | 2mol | 2mol | �ų�c kJ/mol | ||
�� | 3mol | 2mol | ����d kJ/mol |
A.X��ת����Ϊ���ף��ң���
B.c+d��Q
C.ƽ��ʱ���������еķ�Ӧ���ʱȶ������е���
D.ƽ��ʱ��������Z�����ʵ���Ũ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
�غ͵����ػ������ڻ�����ҽҩ�����ϵ��������Ź㷺��Ӧ�á��ش��������⣺
��1��Ԫ��K����ɫ��Ӧ���Ϻ�ɫ��������ɫ��Ӧ�ķ��䲨��Ϊ_______nm�����ţ���
A��404.4 B��553.5 C��589.2 D��670.8 E.766.5
��2����̬Kԭ���У��������ռ�ݵ�����ܲ�ķ�����_________��ռ�ݸ��ܲ���ӵĵ���������ͼ��״Ϊ___________��K��Cr����ͬһ���ڣ��Һ����������ӹ�����ͬ��������K���۵㡢�е�ȶ��Ƚ���Cr�ͣ�ԭ����___________________________��
��3��X��������ⶨ�ȷ��֣�I3AsF6�д���I3+���ӡ�I3+���ӵļ��ι���Ϊ_____________������ԭ�ӵ��ӻ���ʽΪ________________��
��4��KIO3������һ���������õķ����Թ�ѧ���ϣ����и��ѿ��͵�����ṹ���߳�Ϊa=0.446nm��������K��I��O�ֱ��ڶ��ǡ����ġ�����λ�ã���ͼ��ʾ��K��O�����̾���Ϊ______nm����K���ڵ�O����Ϊ__________��
��5����KIO3�����ṹ����һ�ֱ�ʾ�У�I���ڸ�����λ�ã���K����______λ�ã�O����______λ�á�
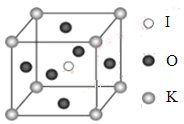
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com