
 ;J的分子式是C8H8O3.
;J的分子式是C8H8O3.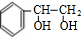 +O2$→_{△}^{Ag}$
+O2$→_{△}^{Ag}$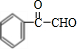 +2H2O;反应类型属于氧化反应
+2H2O;反应类型属于氧化反应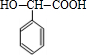 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$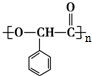 +n H2O
+n H2O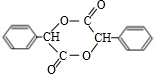 .
. .
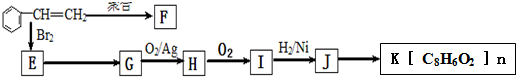
.分析 苯乙烯发生聚合反应生成F,F的结构简式为 ,苯乙烯与溴发生加成反应生成E,故E为
,苯乙烯与溴发生加成反应生成E,故E为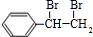 ,G连续氧化生成I,则E发生水解反应生成G,则G为
,G连续氧化生成I,则E发生水解反应生成G,则G为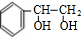 ,H为
,H为 ,I为
,I为 ,I与氢气反应加成反应J为
,I与氢气反应加成反应J为 ,J发生缩聚反应生成K为
,J发生缩聚反应生成K为 ,据此解答.
,据此解答.
解答 解:苯乙烯发生聚合反应生成F,F的结构简式为 ,苯乙烯与溴发生加成反应生成E,故E为
,苯乙烯与溴发生加成反应生成E,故E为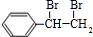 ,G连续氧化生成I,则E发生水解反应生成G,则G为
,G连续氧化生成I,则E发生水解反应生成G,则G为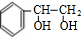 ,H为
,H为 ,I为
,I为 ,I与氢气反应加成反应J为
,I与氢气反应加成反应J为 ,J发生缩聚反应生成K为
,J发生缩聚反应生成K为 .
.
(1)I为 ,所含官能团的名称为:羧基、羰基,
,所含官能团的名称为:羧基、羰基,
故答案为:羧基、羰基;
(2)聚合物F的结构简式是 ;J为
;J为 ,J的分子式是C8H8O3,
,J的分子式是C8H8O3,
故答案为: ;C8H8O3;
;C8H8O3;
(3)G转化为H的化学方程式是: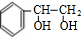 +O2$→_{△}^{Ag}$
+O2$→_{△}^{Ag}$ +2H2O,属于氧化反应,
+2H2O,属于氧化反应,
故答案为: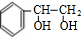 +O2$→_{△}^{Ag}$
+O2$→_{△}^{Ag}$ +2H2O,氧化反应;
+2H2O,氧化反应;
(4)J转化为K的化学方程式是:n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +n H2O,
+n H2O,
故答案为:n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +n H2O;
+n H2O;
(5)在一定条件下,两分子 能脱去两分子水形成一种六元环状化合物,该化合物的结构简式 为:
能脱去两分子水形成一种六元环状化合物,该化合物的结构简式 为: ,
,
故答案为: ;
;
(6) 的两种符合下列条件的同分异构体:(1)遇三氯化铁显紫色,说明含有酚羟基,(2)能发生银镜反应,说明含有醛基或甲酸形成的酯基,(3)苯环上的一氯代物只有两种,应含有2个不同的取代基且处于对位,符合条件X的结构简式为:
的两种符合下列条件的同分异构体:(1)遇三氯化铁显紫色,说明含有酚羟基,(2)能发生银镜反应,说明含有醛基或甲酸形成的酯基,(3)苯环上的一氯代物只有两种,应含有2个不同的取代基且处于对位,符合条件X的结构简式为: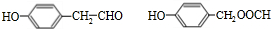 ,
,
故答案为: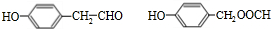 .
.
点评 本题考查有机物的推断与合成,涉及烯烃、卤代烃、醇、醛、羧酸的性质等,注意解反应条件进行推断,熟练掌握官能团的性质与转化,(6)中限制条件同分异构体的书写,为易错点,注意根据题目信息确定含有的官能团.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
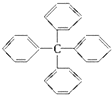 甲烷分子中的四个氢原子都可以被取代.若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示,对所得分子的描述,不正确的是( )
甲烷分子中的四个氢原子都可以被取代.若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示,对所得分子的描述,不正确的是( )| A. | 分子式为C25H20 | |
| B. | 其一氯代物共有三种 | |
| C. | 所有碳原子有可能都在同一个平面内 | |
| D. | 此物质属于芳香烃类物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的反应速率与B的生成速率相等 | |
| B. | 单位时间内生成2n mol A,同时生成3n mol B | |
| C. | A、B、C的浓度不再变化 | |
| D. | A、B、C的浓度之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
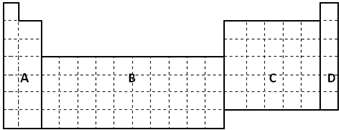
| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
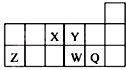
| A. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ | |
| B. | 离子Y2-和Z3+的核外电子数和电子层数都不相同 | |
| C. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 | |
| D. | 元素Y的单质比元素X的单质更容易与氢气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
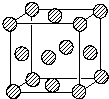 前四周期原子序数依次增大的六种元素,A、B、C、D、E、H中,A元素在宇宙中含量最丰富,B元素基态原子的核外有3种能量不同的原子轨道,且每种轨道中的电子数目相同.D元素是地壳中含量最多的元素,E为d区元素,其外围电子排布中有4对成对电子,H元素基态原子最外层只有一个电子,其它层均已充满电子.
前四周期原子序数依次增大的六种元素,A、B、C、D、E、H中,A元素在宇宙中含量最丰富,B元素基态原子的核外有3种能量不同的原子轨道,且每种轨道中的电子数目相同.D元素是地壳中含量最多的元素,E为d区元素,其外围电子排布中有4对成对电子,H元素基态原子最外层只有一个电子,其它层均已充满电子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com