
 某研究小组在实验室探究氨基甲酸铵(H2NCOONH4)水解反应速率的测定和分解反应平衡常数.
某研究小组在实验室探究氨基甲酸铵(H2NCOONH4)水解反应速率的测定和分解反应平衡常数.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| △c |
| △t |
| 2.2mol/L-1.9mol/L |
| 6min |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
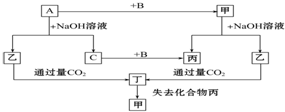 已知单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,甲是一种高熔点的物质.丙常温下是一种液体.根据图示转化关系回答:
已知单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,甲是一种高熔点的物质.丙常温下是一种液体.根据图示转化关系回答:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、降低成本 |
| B、加大发动机动力 |
| C、减少CO2的排放量 |
| D、减少对空气的污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com