
| A. | c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) | B. | c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | ||
| C. | c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) | D. | c(K+)>c(NO3-)>c(Ag+)=(Cl-)+c(I-) |
分析 二者混合时,根据溶度积常数知,先生成AgI,再生成AgCl,AgNO3+KI═AgI↓+KNO3,n(KI)=0.01mol•L-1×0.005L=5.0×10-5 mol,消耗n(AgNO3)=5.0×10-5mol,后发生反应AgNO3+KCl═AgCl↓+KNO3,过量的AgNO3为0.01 mol•L-1×0.008L-5.0×10-5 mol=3.0×10-5mol,而KCl为n(KCl)=0.01mol•L-1×0.005L=5.0×10-5 mol,则KCl过量,生成AgCl为3.0×10-5 mol,由此得出反应后溶液中的溶质为KNO3、KCl,生成AgCl、AgI沉淀,据此判断溶液中各离子浓度大小.
解答 解:二者混合时,根据溶度积常数知,先生成AgI,再生成AgCl,AgNO3+KI═AgI↓+KNO3,n(KI)=0.01mol•L-1×5 mL=5.0×10-5 mol,消耗n(AgNO3)=5.0×10-5mol,
然后发生反应AgNO3+KCl═AgCl↓+KNO3,过量的AgNO3为0.01 mol•L-1×0.008L-5.0×10-5 mol=3.0×10-5mol,而KCl为n(KCl)=0.01mol•L-1×5 mL=5.0×10-5 mol,则KCl过量,生成AgCl为3.0×10-5 mol,由此得出反应后溶液中的溶质为KNO3、KCl,生成AgCl、AgI沉淀,
溶液中钾离子、硝酸根离子不参加反应,根据物料守恒得c(K+)>c(NO3-),氯离子有剩余,所以其次是氯离子浓度较大,氯离子抑制碘化银溶解,所以碘离子浓度最小,
所以离子浓度大小顺序为:c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-),
故选A.
点评 本题考查溶液中离子浓度大小比较、难溶物溶解平衡及溶度积的计算,题目难度中等,本题注意溶液中各物质的量计算出剩余c(Cl-),再根据Ksp计算银离子浓度和碘离子浓度.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 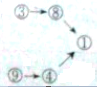 | B. | 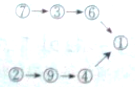 | C. | 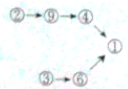 | D. | 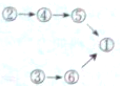 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部正确 | B. | 除②以外 | C. | 除④以外 | D. | 除⑤以外 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | A的初$\frac{始浓度}{mol•{L}^{-1}}$ | B的初$\frac{始浓度}{mol•{L}^{-1}}$ | 生成C的$\frac{初始速率}{mol•{L}^{-1}•{s}^{-1}}$ |
| 1 | 1.0 | 1.0 | 1.2×10-2 |
| 2 | 2.0 | 1.0 | 2.4×10-2 |
| 3 | 4.0 | 1.0 | 4.9×10-2 |
| 4 | 1.0 | 1.0 | 1.2×10-2 |
| 5 | 1.0 | 2.0 | 4.8×10-2 |
| 6 | 1.0 | 4.0 | 1.9×10-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b>c | B. | a>c>b | C. | c>b>a | D. | b>c>a |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将AlCl3溶液蒸发结晶提取无水AlCl3 | |
| B. | 用饱和的NaOH热溶液除去乙酸乙酯中的乙醇、乙酸 | |
| C. | 在温水瓶中加入Na2CO3溶液泡浸后加入盐酸除去内壁上CaSO4 | |
| D. | 将Cl2、HCl混合气体通过盛有NaHCO3饱和溶液的洗气瓶除去HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸的摩尔质量是98g | |
| B. | 2mol OH-的质量是34g | |
| C. | 铁原子的摩尔质量等于它的相对原子质量 | |
| D. | 1mol N2的质量是14g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com