
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.
Ⅰ、实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑.
实验室制取时,将工业用氢氧化钙和甲醛依次加入到 质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是____________。
(2)反应温度最好控制在30-70℃之间,温度不宜过高,其主要原因是____________。
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是____________。
(4)实验时需强力搅拌45min,其目的是____________;结束后需调节溶液的pH 7~8,其目的是____________,最后经结晶分离、干燥得产品.
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合下图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)。

金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
请补充完整由碳酸钙制备甲酸钙的实验方案:
步骤一:称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用;
步骤二:____________;
步骤三:____________;
步骤四:过滤后,将滤液与甲酸钠溶液混合,调节溶液pH7-8,充分搅拌,所得溶液经过 、 、洗涤、60℃干燥得甲酸钙晶体。
提供的试剂有:a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水。
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
对处于平衡状态的反应2A(g)+B(g) 2C(g) ΔH<0,下列叙述正确的是 (
2C(g) ΔH<0,下列叙述正确的是 (  )
)
A.升高温度,v正减小,v逆增大 B.增大A浓度的瞬间,v正增大,v逆不变
C.增大压强,v正增大,v逆减小 D.加入正催化剂,v正增大,v逆减小
查看答案和解析>>
科目:高中化学 来源:2017届江苏省淮安市高三12月考试化学试卷(解析版) 题型:选择题
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g)  2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表:下列说法正确的是
2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2 min的平均速率v(Z)=2.0×10-3 mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正)
C.保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol 气体Y,到达平衡时,n(Z)=0.24 mol
D.该温度下此反应的平衡常数:K=1.44
查看答案和解析>>
科目:高中化学 来源:2017届广东省七校联合体高三上学期第二次联考化学试卷(解析版) 题型:填空题
汽车尾气中的NOx是大气污染物之一,用CH4催化还原NOx可以消除氮氧化物的污染。
(1)已知:
①CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
②CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ·mol-1
③CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) △H3= 。
N2(g)+CO2(g)+2H2O(g) △H3= 。
(2)反应③在热力学上趋势很大,其原因是 。在固定容器中按一定比例混合CH4与NO2后,提高NO2转化率的反应条件是 。
(3)在130℃和180℃时,分别将0.50mol CH4和a mol NO2充入1L的密闭容器中发生反应③,测得有关数据如下表:
实验编号 | 温度 | 0分钟 | 10分钟 | 20分钟 | 40分钟 | 50分钟 | |
1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
① 开展实验1和实验2的目的是 。
② 130℃时,反应到20分钟时,NO2的反应速率是 。
③ 180℃时达到平衡状态时,CH4的平衡转化率为 。
④ 已知130℃时该反应的化学平衡常数为6.4,试计算a= 。
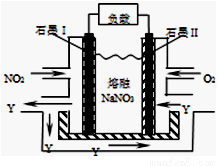
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图。该电池在使用过程中石墨I电极上生成氧化物Y,该电极反应为 。
查看答案和解析>>
科目:高中化学 来源:2017届广东省七校联合体高三上学期第二次联考化学试卷(解析版) 题型:选择题
设阿伏加德罗常数的值为NA,则下列说法正确的是
A.标准状况下,22.4 L乙烯含有的共用电子对数为5NA
B.1 mol NaHSO4中的阳离子数为2NA
C.通常状况下,1 mol NO和0.5 molO2 在密闭容器中混合,生成NO2分子数为NA
D.制取漂白粉时,标准状况下22.4 LCl2 参加反应,转移电子数为NA
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上12月月考化学卷(解析版) 题型:选择题
pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3 mol·L-1,则该溶液中该溶质的pC=-lg(1×10-3)=3。如图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5 mol·L-1,可认为该离子不存在)。下列说法不正确的是

A.某温度下,CO2饱和溶液的浓度是0.05 mol•L-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH约为5,据此可得该温度下CO2饱和 溶液中H2CO3的电离度约为0.1% ,
溶液中H2CO3的电离度约为0.1% ,
B.25℃时,H2CO3一级电离平衡常数的数值Ka1=10-6
C.向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32﹣)+c(OH﹣)+c(HCO3﹣)
D.25℃时,0.1 mol·L-1Na2CO3中c(HCO3﹣)比0.1 mol·L-1NaHCO3中c(HCO3﹣)大
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上12月月考化学卷(解析版) 题型:选择题
下列实验中根据现象得出的结论错误的是
选项] | 实验 | 现象 | 结论 |
A | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是C |
B | 向某溶液中加铜和浓H2SO4 | 试管口有红棕色气体产生 | 原溶液可能含有NO3- |
C | 将打磨过的Al片投到一定浓度的CuCl2溶液中 | 出现气泡并有固体生成,过滤,向固体中加入过量的氨水,固体部分溶解 | Al与CuCl2溶液反应,有H2和Cu(OH)2生成 |
D | 向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]> Ksp[Cu(OH)2] |
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上模拟四化学试卷(解析版) 题型:选择题
已知X、Y、Z三种主族元素在元素周期表中的位置如图所示。设X的原子序数为a,则下列说法不正确的是
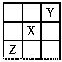
A. Y的原子序数可能为a-17
B. Y与Z的原子序数之和可能为2a
C. Z的原子序数可能为a+31
D. X、Y、Z一定为短周期元素
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一月考二化学卷(解析版) 题型:填空题
Ⅰ.现有下列十种物质: ①O2; ②Fe; ③CaO; ④CO2; ⑤H2SO4; ⑥Ba(OH)2;⑦红褐色的氢氧化铁胶体; ⑧硫酸钠溶液; ⑨稀硝酸; ⑩Cu2(OH)2CO3。
(1)按物质的树状分类法填写表格的空白处:
分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 |
属于该类的物质 | ② | ⑧⑨ |
(2)上述物质中属于非电解质的有_________;上述物质中能与盐酸反应的电解质有________(填序号)。
Ⅱ.(1)在 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O 的反应中,氧化剂是_________,还原产物是_________,氧化产物与还原产物的质量比是_________。
(2)在反应 MnO2+4HCl=MnCl2+Cl2↑+2H2O 中,每生成标准状况下4.48LCl2,转移的电子的物质的量为___________mol。
Ⅲ.Mn2+、 Bi3+、 BiO3-、 MnO4-、 H+、 H2O 组成的一个氧化还原反应体系中,发生BiO3-→Bi3+的反应过程,据此回答下列问题:
将以上物质分别填入下面对应的横线上,组成一个未配平的化学方程式。
________+ _________+ ________→ _________+ ________+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com