
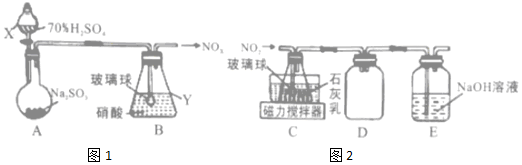
分析 A装置由浓硫酸和亚硫酸钠制备二氧化硫气体,二氧化硫气体与硝酸在B中反应生成氮氧化合物,在C中与石灰乳发生反应NO+NO2+Ca(OH)2=Ca(NO2)2+H2O,可制备得Ca(NO2)2,D装置防倒吸,E装置用氢氧化钠吸收未反应完的氮氧化物,防止污染空气,据此分析解答;
(1)①由仪器构造可判断X的仪器名称;
②装置B中逸出的NO与NO2的物质的量之比为1:1,NO和NO2是还原产物,则SO2的氧化产物应为硫酸,可结合电子守恒判断SO2与硝酸的物质的量之比,再结合原子守恒写出此反应的化学方程式;硝酸的浓度越大,硝酸氧化性增强,还原产物的价态越高,且浓硝酸可氧化NO氧化为NO2;
(2)①利用玻璃球可增大气体与溶液的接触面积;
②D装置是安全瓶,再结合气体NO2易溶于NaOH溶液判断,NO2是有毒气体,对环境有污染;
(3)①由信息Ca(NO2)2能被酸性KMnO4溶液氧化成NO3-,可根据消耗的酸性KMnO4溶液,利用电子守恒来计算Ca(NO2)2并测定其纯度;
②由信息在酸性条件下,Ca(NO3)2能将I-氧化为I2,S2O32-能将I2还原为I-可知,根据氧化还原反应的电子守恒,建立关系式,进行计算即可.
解答 解:(1)①由仪器构造可知X为分液漏斗;
故答案为:分液漏斗;
②装置B中逸出的NO与NO2的物质的量之比为1:1,则装置B中发生反应的化学方程式为2SO2+H2O+2HNO3=NO+NO2+2H2SO4;若其它条件不变,增大硝酸的浓度,硝酸氧化性增强,将NO氧化为NO2,则会使逸出的气体中n(NO2)>n(NO);
故答案为:2SO2+H2O+2HNO3=NO+NO2+2H2SO4;>;
(2)①装置C中导管末端接一玻璃球可增大与石灰乳的接触面积;
故答案为:增大与石灰乳的接触面积;
②装置D的作用是防倒吸,E装置用氢氧化钠吸收未反应完的氮氧化物,防止污染空气;
故答案为额:防倒吸;吸收未反应的氮氧化物;
(3)①由信息Ca(NO2)2能被酸性KmnO4溶液氧化成NO3-,MnO4-被还原为Mn2+可知,则利用Ca(NO2)2的还原性来测定其纯度,可选择的试剂是e;
故答案为:e;
②由信息在酸性条件下,Ca(NO3)2能将I-氧化为I2,S2O32-能将I2还原为I-可知,2NO2-~~~~~I2~~~~~~~2S2O32-;消耗NaS2O3的物质的量为c2mol•L-1×V×10-3L=0.001c2Vmol,则Ca(NO2)2的物质的量为0.001c2Vmol×$\frac{1}{2}$,此Ca(NO2)2纯度的表达式为$\frac{0.001{C}_{2}Vmol×\frac{1}{2}×132g/mol}{m}×100%$=$\frac{33{c}_{2}V}{500}×100%$,故答案为:$\frac{33{c}_{2}V}{500}×100%$.
点评 本题考查物质的制备实验,为高频考点,把握制备实验原理、实验装置的作用、氧化还原反应的应用为解答的关键,侧重分析与实验及应用能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 性质 | 用途 | |
| A | Fe2O3 | 红棕色粉末 | 常用作红色油漆和颜料 |
| B | NaHCO3 | 溶液呈碱性 | 可用作食用碱或工业用碱 |
| C | Si | 导电性介于道题与绝缘体之间 | 用于制作计算机芯片、光电池 |
| D | SO2 | 还原性 | 工业上用来漂白纸浆、毛、丝、草帽辫等 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液pH升高的主要原因:Mg+2H+═Mg2++H2↑ | |
| B. | 生成沉淀a的离子方程式:Ag++Cl-═AgCl↓ | |
| C. | 沉淀b是Mg(OH)2 | |
| D. | 若a、b的物质的量关系为n(a):n(b)=1:3,则可推知固体X的化学式为Mg3(OH)6Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验现象 | 结论 | |
| A | 将SO2通人溴水中 | 溴水颜色褪去 | SO2具有漂白性 |
| B | 将铁屑放入稀HNO3中 | 放出无色气体 | Fe比H2活泼 |
| C | 将澄清石灰水滴入某溶液 | 生成白色沉淀 | 溶液中存CO32- |
| D | 将乙烯通入KMnO4酸性溶液 | KMnO4颜色褪去 | 乙烯具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 化石燃料燃烧时采取脱硫措施 | 提高化石燃料的利用率 |
| B | 食品袋中常放有硅胶和铁粉,都能起到干燥的作用 | 二者都有较强的吸水性 |
| C | 高温加热能杀死流感病毒 | 蛋白质受热变性 |
| D | 高铁车厢采用铝合金材料 | 铝和氧气不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟化氢的电子式: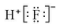 | |
| B. | 氯原子的结构示意图: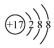 | |
| C. | 丙烯的结构简式:C3H6 | |
| D. | 硫原子的最外层电子排布式:3s23p4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com