
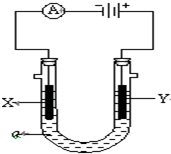
 电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:分析 (1)若X、Y都是惰性电极,a是饱和NaCl溶液,Y电极与电源正极相连为阳极,氯离子放电生成氯气,氯气可以用湿润的淀粉碘化钾试纸检验,X电极上氢离子放电,同时该电极附近生成氢氧根离子;
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,阳极应该是粗铜、阴极是纯铜,则X电极是纯铜、Y电极是粗铜,阴极上铜离子放电,阳极是铜失电子被氧化成铜离子进入溶液中.
解答 解:(1)①若X、Y都是惰性电极,a是饱和NaCl溶液,和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
②若X、Y都是惰性电极,a是饱和NaCl溶液,Y电极上氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,氯气具有氧化性,能氧化碘离子生成碘单质,碘遇淀粉试液变蓝色,所以氯气可以用湿润的淀粉碘化钾试纸检验,故答案为:2Cl--2e-=Cl2↑;将湿润的淀粉碘化钾试纸接近出气口,如果试纸变蓝色就说明生成氯气;
③X电极上氢离子放电,同时该电极附近生成氢氧根离子,Y电极上氯离子放电生成氯气,所以电池反应式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,阳极应该是粗铜、阴极是纯铜,则与电源负极相连的阴极X是纯铜,阴极是铜离子放电,电极反应式为Cu2++2e-=Cu,与电源正极相连的阳极Y是粗铜,阳极发生反应为:Cu-2e-=Cu2+,
故答案为:纯铜; Cu2++2e-=Cu;粗铜;Cu-2e-=Cu2+.
点评 本题考查原电池原理,为高频考点,侧重于学生的分析能力的考查,本题涉及电极反应式的书写等知识点,注意离子放电顺序及电极反应式的书写,题目难度不大.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气:K+、Na+、AlO2-、CO32- | B. | 二氧化硫:Na+、NH4+、SO32-、Cl- | ||
| C. | 氯化氢:H+、K+、MnO4-、SO42- | D. | 二氧化碳:Mg2+、Al3+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂属于酯类,在酸性或碱性条件下与水发生水解反应,称为皂化反应 | |
| B. | 淀粉、纤维素没有甜味,它们都是天然高分子化合物,在一定条件下水解都能生成葡萄糖 | |
| C. | 鸡蛋清的溶液中加入硫酸铜溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 氨基酸分子中都含有-COOH和-NH2二种原子团,能相互反应形成更复杂的多肽化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
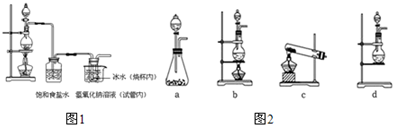
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
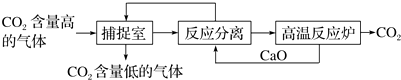
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的还原产物是 I2 | |
| B. | 每生成 1 mol I2,转移的电子为 2 mol | |
| C. | KOH 和 O2 都是还原产物 | |
| D. | 反应中氧化剂与还原剂质量之比为 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
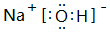 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com