
【题目】分析图,甲、乙具有的共性是
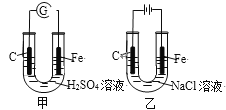
A. 反应物能量均高于生成物能量
B. 电极反应均有Fe-2e→Fe2+
C. 碳棒上均发生氧化反应
D. 溶液pH均增大
【答案】D
【解析】
甲装置是原电池,Fe失去电子、发生氧化反应,电极反应式为Fe-2e-=Fe2+,C电极上发生还原反应、电极反应式为2H++2e-=H2↑;乙装置是电解池,C电极为阳极、发生氧化反应,电极反应式为2Cl--2e-=Cl2↑,Fe电极为阴极、反应还原反应,电极反应式为2H2O+2e-=H2↑+2OH-(或2H++2e-=H2↑),
A.Fe和硫酸发生的置换反应是放热反应,即反应物能量均高于生成物能量,而电解食盐水需要消耗电能,是吸热反应,即反应物能量低于生成物能量,故A错误;
B.甲装置发生Fe-2e-=Fe2+的电极反应,乙装置Fe为阴极,不会发生Fe-2e-=Fe2+的电极反应,电极反应式为2H2O+2e-=H2↑+2OH-,故B错误;
C.甲装置中碳棒上H+得到电子、发生还原反应,乙装置碳棒上Cl-失去电子、发生氧化反应,故C错误;
D.甲装置消耗H+、酸性减弱、pH增大,乙装置生成NaOH、碱性增强、pH增大,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】某同学设计了如下实验装置,进行浓硫酸与蔗糖的反应实验。

(1)实验开始时,先在烧瓶中加入15g蔗糖,并滴入几滴水使蔗糖完全湿润,然后从分液漏斗中加入15mL浓硫酸,水的作用是_________。
(2)实验中烧瓶内黑色物质疏松膨胀的原因是________(用化学方程式表示)。
(3)为了检验实验中产生的CO2,请描述接口a之后的实验操作及现象_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)从电子排布的角度解释Fe2+容易被氧化为Fe3+的原因是:___________
(2)工业用电解氯化镁制得镁,而不用氧化镁的原因____________________
(3)基态金原子的外围电子排布式为5d106s1,试判断金在元素周期表中位于第________周期第________族.
(4)已知Ag与Cu位于同一族,则Ag在元素周期表中位于________区(填s、p、d、f或 ds ).
(5)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有哑铃形![]() 的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的
的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的![]() 数目为________。
数目为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A. 若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B. 由C(石墨)=C(金刚石)ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定
C. 在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)![]() 2H2O(l) ΔH=+285.8 kJ·mol-1
2H2O(l) ΔH=+285.8 kJ·mol-1
D. 在稀溶液中:H++OH-![]() H2O ΔH=-57.3 kJ·mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3 kJ
H2O ΔH=-57.3 kJ·mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表第四周期Ⅷ族,其基态原子中未成对电子个数为___________。
(2)基态Fe3+的核外电子排布式___________
(3)铁氧体是一种磁性材料,工业上制备时常采用水解法,制备时常加入尿素(CO(NH2)2)、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是___________,分子中σ键与π键的数目之比为___________。醋酸钠中碳原子的杂化类型___________。
(4)铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱,已知氨(NH3熔点:-77.8%℃、沸点:-33.5%℃),联氨(N2H4熔点:2℃、沸点:113.5°C)解释其熔沸点高低的主要原因______________________。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数为6,为确定钻的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,则第一种配合物的配体为___________。在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为___________。

(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如上图所示,则该物质的化学式为___________。若品体密度为dg·cm-3,则晶胞中最近的两个碳原子的距离为___________pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合氯化铝晶体([Al2(OH)nCl(6-n)XH2O]m)是一种高效无机水处理剂。它的制备原理是调节AlCl3溶液的pH,通过促进其水解而结晶析出。
回答下列问题:
(1)铝原子核外能量最高的电子有_____个。分析AlCl3熔点较低的原因(熔点:AlCl3—194℃,Al2O3—2054℃,NaCl—801℃)。____________________________________________________
(2)比较聚合氯化铝晶体中同周期两种元素的原子半径,并用原子结构知识说明理由。___________
(3)铝灰(主要成分为Al、Al2O3,另有少量CuO、SiO2、FeO和Fe2O3杂质)可制备AlCl3,如果先除去铝灰中的金属氧化物杂质可选用__________(选填:“强碱”或“强酸”)。写出其中Al发生反应的离子方程式_______________________________。
(4)制备聚合氯化铝晶体,需严格控制溶液的pH在4.0~4.5才能使产率达到最大。结合AlCl3水解的离子方程式,用化学平衡移动原理解释控制pH在4.0~4.5之间的原因_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 电解精炼铜时转移了NA个电子,阳极溶解了32g铜
B. 1mol FeCl3完全水解后可生成NA个氢氧化铁胶粒
C. 常温下,1mol氯气通入足量水中发生反应转移的电子数为NA
D. 100mL 0.1mol/L Na2CO3溶液中含有的阴离子数目大于0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图甲所示。向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图乙所示。
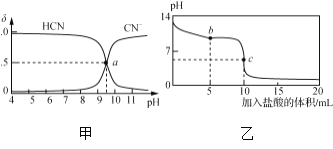
下列溶液中微粒的物质的量浓度关系一定正确的是( )
A. 图甲中pH=7的溶液:c(Cl-)=c(HCN)
B. 图甲中a点的溶液:c(CN-)<c(Cl-)
C. 图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D. 图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M为一种香料的中间体。实验室由芳香烃A制备M的一种合成路线如下:

已知:

(R1、R2、R3表示烃基或氢原子)
(1)A的结构简式为__________。B的化学名称为____________________。
(2)C中所含官能团的名称为__________。
(3)F→G、G+H→M的反应类型分别为__________、__________。
(4)E→F的第一步反应的化学方程式为____________________。
(5)同时满足下列条件的E的同分异构体有__________种(不考虑立体异构)。
①属于芳香族化合物
②既能与新制Cu(OH)2反应生成砖红色沉淀,又能发生水解反应
其中核磁共振氢谱显示有4组峰的结构简式为______________________________。
(6)参照上述合成路线和信息,以1,3一环己二烯为原料(无机试剂任选),设计制备聚丁二酸乙二酯的合成路线:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com