
| A. | 浓硫酸和浓盐酸在空气中敞口放置时浓度均减少 | |
| B. | SO2和Cl2均能使品红溶液褪色 | |
| C. | 浓H2SO4和稀H2SO4与锌反应时均能产生气体 | |
| D. | H2S、HI气体均不能用浓H2SO4制取 |
分析 A.浓硫酸具有吸水性,盐酸易挥发;
B.二氧化硫与有色物质发生化合反应,氯水中的次氯酸具有强氧化性而是有色物质漂白;
C.分别生成二氧化硫和氢气;
D.H2S、HI都具有还原性.
解答 解:A.浓硫酸具有吸水性,盐酸易挥发,二者防止空气中浓度都变小,但原理不同,故A错误;
B.二氧化硫与有色物质发生化合反应,氯水中的次氯酸具有强氧化性而是有色物质漂白,二者漂白原理不同,二氧化硫的漂白不稳定,加热可恢复到原来的颜色,故B错误;
C.浓硫酸与锌反应生成二氧化硫,稀硫酸与锌反应生成氢气,故C错误;
D.H2S、HI都具有还原性,都可与浓硫酸发生氧化还原反应而不能用浓硫酸干燥,故D正确.
故选D.
点评 本题综合考查元素化合物知识,侧重于基础知识的考查,难度不大,注相关基础知识的积累,把握相关物质的性质.


科目:高中化学 来源: 题型:选择题
| A. | 0.45mol | B. | 0.8mol | C. | 0.6mol | D. | 0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
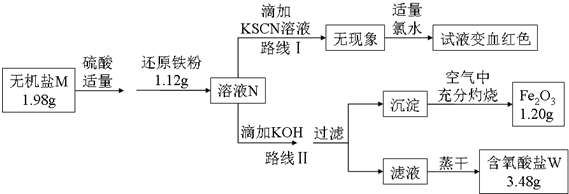
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
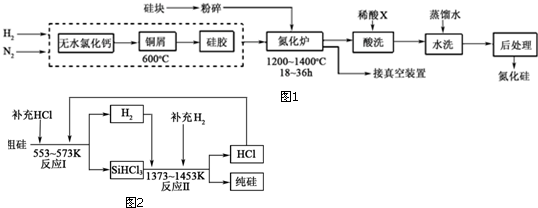
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中只含离子键 | |
| B. | 共价化合物可能含离子键 | |
| C. | 离子化合物可能含共价键 | |
| D. | 直接相邻的原子或离子之间的相互作用称为化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的PH | 4.79 | 4.62 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一次剩余4.8g金属为铜和铁 | |
| B. | 稀硝酸的物质的量浓度为1.0mol•L-1 | |
| C. | 原混合物中铜和铁各0.075mol | |
| D. | 再加入上述100mL稀硝酸,又得到标准状况下1.12LNO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com