
| A、太阳能电池板中的硅,在元素周期表中处于金属与非金属的交界位置 |
| B、煤的气化或液化技术,可以降低污染 |
| C、镁粉可用来作信号弹和烟花,氧化镁可制作耐高温材料 |
| D、NaHCO3能与碱反应,因此食品工业用小苏打做焙制糕点的膨松剂 |


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试样 | 所加试剂 | 实验现象及测定数值 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 溶液呈蓝色 |
| 第二份试液 | 滴加过量的盐酸酸化的BaCl2溶液 | 白色沉淀0.932g |
| 第三份试液 | 滴加0.01mol/LNaOH溶液体积V,与生成沉淀的关系,如右图 | 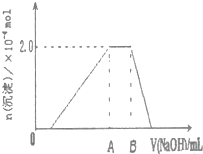 |
| 第四份试液 | 滴加过量的AgNO3 | 白色沉淀1.535g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3 |
| B、NaOH和Na2CO3 |
| C、Na2O2和Na2CO3 |
| D、Na2O2、NaOH和Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2 (SO4)3 |
| B、O2 |
| C、Cu (NO3)2 |
| D、FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
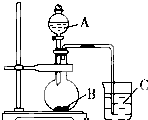 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com