
| A、Na2CO3是钠盐 |
| B、Na2CO3是盐 |
| C、Na2CO3是碱 |
| D、Na2CO3是碳酸盐 |


科目:高中化学 来源: 题型:
| A、Na+、CO32-、Cl- |
| B、Ba2+、Na+、Cl- |
| C、H+、SO42-、OH- |
| D、Ag+、Al3+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、播撒碳酸钙粉末可治理被酸雨污染的湖泊 |
| B、火力发电是将化学能直接转化为电能 |
| C、维生素C具有还原性,可消除体内具有强氧化性的物质 |
| D、过量服用阿司匹林引起酸中毒,可静脉注射NaHCO3溶液解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
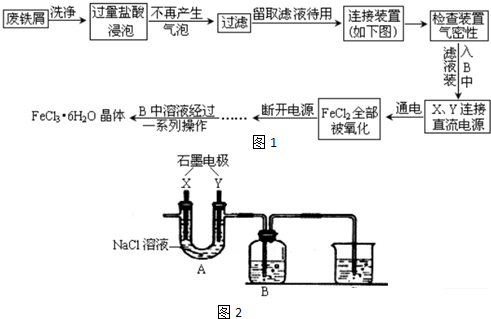
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Ba(OH)2溶液中滴加NaHSO4至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| B、硫化钠溶液显碱性的原因:S2-+2H2O=H2S+2OH- |
| C、向碳酸钠溶液中通入少量的二氧化硫:2SO2+CO32-+H2O=2HSO3-+CO2↑ |
| D、氯化亚铁溶于稀硝酸中;3FeO+NO3-+10H+=3Fe3++NO↑+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 分类标准 | 能导电 | 非电解质 | 电解质 |
| 属于该类的物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com