
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
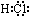 ,故答案为:
,故答案为: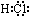 ;
;

 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
| 实验目的 | 所加试剂(或操作、图示) | 实验现象 | 实验结论 | |||||
| A | 检验稀盐酸和氢氧化钠溶液是否恰好完全反应 | 在反应后的溶液中滴加无色酚酞试液 | 无明显现象 | 恰好完全反应 | ||||
| B | 判断海水和蒸馏水 | 蒸发结晶 | 液体消失,无残留物 | 该液体为蒸馏水 | ||||
| C | 检验溶液中是否含碳酸根离子或碳酸氢根离子 | 加入稀盐酸再将气体通入石灰水中 | 有无色无味气体产生,且石灰水中有白色浑浊形成 | 溶液中一定含碳酸根离子或碳酸氢根离子 | ||||
| D | 测定空气中氧气的体积分数 |  |
完全燃烧后,冷却至室温,打开弹簧夹,进入水的体积约为集气瓶中空气体积的
|
氧气约占空气体积的
|
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知在常温下,常见弱酸和弱碱的电离平衡常数如下表所示:
(1)已知在常温下,常见弱酸和弱碱的电离平衡常数如下表所示:| 电解质 | HF | CH3COOH | HNO2 | NH3?H2O |
| 电离平衡常数K | 3.53×10-4 | 1.76×10-5 | 4.6×10-4 | 1.77×10-5 |
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| H+ |
| ①转化 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/K | 反应① | 反应② | 反应③ |
| 298 | 2.96×109 | 2.53×109 | 1.32×1015 |
| 423 | 1.05×102 | 5.40×102 | 2.52×102 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用图1所示装置除去Cl2中含有的少量HCl |
| B、用图2所示装置蒸发KCl溶液制备无水KCl |
| C、用图3所示装置可以完成“喷泉”实验 |
| D、用图4所示装置制取、收集干燥纯净的NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com