
分析 已知:①Si(s)+O2(g)═SiO2(s)△H1=-910.9kJ/mol
②2Si(s)+3H2(g)═Si2H6(g)△H2=+80.3kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ/mol
根据盖斯定律,③×3-②+①×2可得:Si2H6(g)+$\frac{7}{2}$O2(g)═2SiO2(s)+3H2O(l),反应热△H也进行相应的计算.
解答 解:已知:①Si(s)+O2(g)═SiO2(s)△H1=-910.9kJ/mol
②2Si(s)+3H2(g)═Si2H6(g)△H2=+80.3kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ/mol
根据盖斯定律,③×3-②+①×2可得:Si2H6(g)+$\frac{7}{2}$O2(g)═2SiO2(s)+3H2O(l),故△H=3×(-285.8kJ/mol)-80.3kJ/mol+2×(-910.9kJ/mol)=-2759.5kJ/mol,
故答案为:-2759.5kJ/mol.
点评 本题考查用盖斯定律进行反应热的计算,难度不大,关键是构造目标方程式.


科目:高中化学 来源: 题型:选择题
| A. | 除去Na2CO3 固体中混有的少量的NaHCO3:置于坩埚中加热 | |
| B. | 除去FeCl2溶液中的FeCl3:加入铁粉 | |
| C. | 除去氢氧化铁胶体中所含的盐酸:过滤 | |
| D. | 除去CO2中混有的少量的HCl:通过饱和的NaHCO3溶液中洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
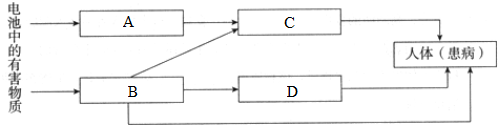
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 氢氧化钡溶液与稀 H2SO4:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| C. | 向氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 钠和冷水反应:Na+2H2O=Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
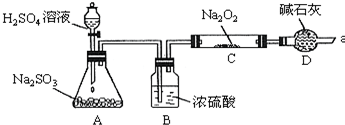

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间.下列说法不正确的是( )
利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间.下列说法不正确的是( )| A. | a处溶液的pH增大,b处溶液的pH减小 | |
| B. | 一段时间后,a管液面高于b管液面 | |
| C. | a管发生吸氧腐蚀,b管发生析氧腐蚀 | |
| D. | a、b两处具有相同的电极反应式:Fe-2e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1:1 | B. | 1:1:2 | C. | 1:2:1 | D. | 4:3:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
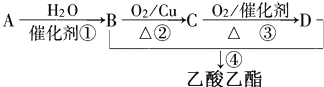
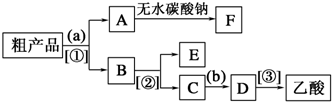
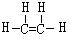 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 高温下,0.3molFe与足量水蒸气反应,生成的H2的体积为8.96L | |
| C. | 1mol Na2O2固体中含离子总数为4 NA | |
| D. | 标准状况下6.72 L NO2与水反应转移的电子数0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com