
【题目】下列各组离子在指定溶液中一定大量共存的是( )
A. 含有AlO2-的溶液中:Na+ 、Al3+、Cl-、K+
B. 常温下由水电离出的c(H+)·c(OH-)=10-20 mol2·L-2的溶液中:Na+、NH![]() 、Cl-
、Cl-
C. 常温下 c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
D. 在c(H+)=1.0×10-13 mol·L-1的溶液中:Na+、S2-、AlO2-、SO32-
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,在实验室中可以用下图所示装置制备1,2二溴乙烷。其中A和F中装有乙醇和浓硫酸的混合液,D中的试管里装有液溴。可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。(夹持装置已略去)

有关数据列表如下:

填写下列空白:
(1)A的仪器名称是____。
(2)安全瓶B可以防止倒吸,还可以检查实验进行时导管是否发生堵塞。请写出发生堵塞时瓶B中的现象____。
(3)A中发生反应的化学方程式为:____;D中发生反应的化学方程式为:____。
(4)在装置C中应加入____(填字母),其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(5)若产物中有少量副产物乙醚,可用___(填操作名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)被称为21世纪的新型燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
(1)该工艺的总反应为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) ΔH=_________,化学平衡常数K=______________(用含K1、K2、K3的代数式表示)。
CH3OCH3(g)+CO2(g) ΔH=_________,化学平衡常数K=______________(用含K1、K2、K3的代数式表示)。
化学反应方程式 | 化学平衡常数 | |
①CO(g)+2H2(g) | ΔH1=-99 kJmol-1 | K1 |
②2CH3OH(g) | ΔH2=-24 kJmol-1 | K2 |
③CO(g)+H2O(g) | ΔH3=-41 kJmol-1 | K3 |
(2)某温度下,将8.0molH2和4.0molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________,CO的转化率为________。
CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________,CO的转化率为________。
(3)下列措施中,能提高CH3OCH3产率的有________。
A.分离出二甲醚 B.降低温度 C.改用高效催化剂D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率,原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:

(1)表中化学性质最不活泼的元素,其原子结构示意图为______。
(2)元素⑦与⑧的原子半径大小关系是:⑦______⑧(填“>”或“<”)。
(3)④⑤两元素相比较,金属性较强的是______ (填元素名称)。
(4)元素①的最高价氧化物的水化物的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 把100mL3mo/LH2SO4溶液与100mL1mo/LBaCl2溶液混合,所得溶液c(SO42-)变为1mol/L
B. 把200mL3mol/LBaCl2溶液与100mL3mol/LKCl 溶液混合后,所得溶液c(Cl-)仍为3mol/L
C. 把100mL20%的NaOH溶液与100mLH2O混合后,所得溶液中NaOH的质量分数为10%
D. 把100g20%的NaCl溶液与100mLH2O混合后,所得溶液中NaCl的质量分数为10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法与盐类水解有关且正确的是: ( )
A. AlCl3溶液和NaAlO2溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同
B. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
C. 用加热的方法可除去KCl溶液中混有的Fe3+
D. 食醋可以溶解水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物G是可被细菌作为碳源和能源利用的聚合物,属于一种生物可降解高分子材料,在食品、药品包装方面具有独特优势。已知A~G均为有机化合物,以下为高分子化合物G的一种合成路线:
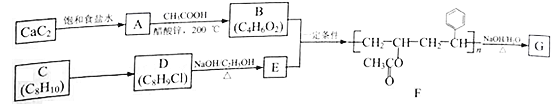
回答以下问题:
(1)由CaC2制备A的化学方程式为_________________________________。
(2)A生成B的反应类型为______________________。
(3)C的化学名称是___________,C→D所需试剂和条件分别是___________、___________。
(4)E的结构简式为______________________。
(5)芳香族化合物H是D的同分异构体,则H可能的结构共有___________种(不包括D),写出核磁共振氢谱有三组峰且峰面积之比为1︰2︰6的H的同分异构体的结构简式___________(任写一种)。
(6)由F生成G的化学方程式为_________________________________。
(7)参考题中信息,设计由1,2二氯乙烷和冰醋酸为原料制取![]() 的合成线路图(无机试剂任选)__________________。
的合成线路图(无机试剂任选)__________________。
已知:-OH与碳碳双键两端的碳原子直接相连不稳定,会自变成—CHO。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高氯冶炼烟灰(主要成分为铜锌的氯化物、氧化物、硫酸盐,少量铁元素和砷元素)为原料,可回收制备Cu和ZnSO4·H2O,其主要实验流程如下:

已知:①Fe3+完全沉淀pH为3.2,此时Zn2+、Cu2+未开始沉淀;②K3[Fe(CN)6]可用于检验Fe2+:3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓(深蓝色);③砷元素进入水体中对环境污染大,可通过沉淀法除去。
(1)两段脱氯均需在85 ℃条件下进行,适宜的加热方式为________。
(2)碱洗脱氯时,溶液中Cu2+主要转化为Cu(OH)2和Cu2(OH)2CO3,也会发生副反应得到Cu2(OH)3Cl沉淀并放出气体,该副反应的离子方程式为________________________。若用NaOH溶液进行碱洗操作时,浓度不宜过大,通过下表的数据分析其原因是___________。
NaOH溶液浓度对脱氯率和其他元素浸出率的影响

(3)ZnSO4的溶解度曲线如下图所示。“电解”后,从溶液中回收ZnSO4·H2O的实验、操作为___________。

(4)滤液1和滤液2中含一定量的Cu2+、Zn2+。为提高原料利用率,可采取的措施有:将滤液1和滤液2混合,回收铜锌沉淀物;循环使用电解过程产生的________(填化学式)。
(5)已知H3AsO3的还原性强于Fe2+,Ksp(FeAsO3)>Ksp(FeAsO4)=5.7×10-21。测得酸浸液中杂质铁元素(以Fe2+存在)、砷元素(以H3AsO3存在)的浓度分别为1.15 g·L-1、0.58 g·L-1,可采用“氧化中和共沉淀”法除去,请设计实验方案: ____________________________(实验中须使用的试剂有:30%双氧水,0.001 mol·L-1K3[Fe(CN)6]溶液,回收的铜锌沉淀物)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了延长水果的保鲜期,下列的水果存放方法最合适的是
A.放入敞口的容器中 B.放入浸泡过高锰酸钾溶液硅土的密封容器中
C.放入密封的容器中 D.放入充有少量乙烯的密封容器中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com