
| 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
分析 由制备流程可知,锂辉石加硫酸,浸取焙烧,氧化铝、氧化锂溶解,二氧化硅不反应,水浸时加入碳酸钙,除去为反应的硫酸,同时调节溶液pH值,可以将Al3+转化为Al(OH)3沉淀,过滤除去不溶物,滤液再进行深度净化后主要为Li2SO4、Na2SO4,最后加入Na2CO3,转化为溶解度更小Li2CO3析出,据此分析.
解答 解:(1)(1)锂辉石(Li2Al2Si4Ox)可以用氧化物的形式表示,Li元素化合价+1价,铝元素+3价,氧元素-2价,硅元素+4价,根据化合价代数和为0,可以确定Li2Al2Si4Ox中x=12,所以该化合物用氧化物的形式表示为Li2O•Al2O3•4SiO2;
故答案为:Li2O•Al2O3•4SiO2;
(2)温度低于250℃,反应速率较慢,温度高于300℃,硫酸挥发较多,反应温度控制在250-300℃,反应速率较快,避免硫酸挥发;
硫酸如果加入过多,消耗的酸多,后续中还需要除去过量的硫酸,增加后续杂质的处理量、增加后续中和酸的负担;
故答案为:温度低于250℃,反应速率较慢,温度高于300℃,硫酸挥发较多;后续中还需要除去过量的硫酸,增加后续杂质的处理量、增加后续中和酸的负担;
(3)水浸时,加入CaCO3粉末充分反应后过滤,滤渣的主要成分除CaCO3外还有CaSO4、SiO2、Al(OH)3;
故答案为:CaSO4、SiO2、Al(OH)3;
(4)“沉锂”过程是碳酸钠与Li2SO4反应生成Li2CO3,反应方程式为:Na2CO3+Li2SO4=Li2CO3↓+Na2SO4,
故答案为:Na2CO3+Li2SO4=Li2CO3↓+Na2SO4;
(5)温度越高,碳酸锂溶解度降低,减少碳酸锂溶解,可以增加产率;溶液中硫酸钠不反应,使用的碳酸钠要过量,少量碳酸锂溶解在溶液中,过滤碳酸锂所得母液中主要含有硫酸钠,还可能含有碳酸钠、碳酸锂;
故答案为:温度越高,碳酸锂溶解度降低,可以增加产率;碳酸钠;碳酸锂.
点评 本题考查物质的制备实验,为高频考点,把握制备实验流程、物质分离提纯实验操作、对操作与原理的分析评价等为解答的关键,是对学生综合能力的考查,注意对工艺流程的理解,题目难度较大.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | H+、Ba2+、Cl-、AlO2- | B. | Fe3+、SO42-、Na+、OH- | ||
| C. | Na+、OH-、SiO32-、Cl- | D. | Na+、HCO3-、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | +485 kJ•mol-1 | B. | -485 kJ•mol-1 | C. | +1940 kJ•mol-1 | D. | -1940 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
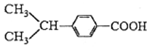 与
与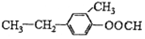
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol FeSO4发生反应时,反应中共有10 mol电子转移 | |
| B. | 每生成16g氧气就有1molFe2+被还原 | |
| C. | Na2O2只作氧化剂 | |
| D. | 氧化产物只有Na2FeO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2溶于水生成的H2SiO3的酸性弱于H2CO3 | |
| B. | SiO2是一种熔点小、硬度低的氧化物 | |
| C. | SiO2能和氢氧化钠溶液反应,因此保存氢氧化钠溶液不能用玻璃塞 | |
| D. | SiO2是一种酸性氧化物,所以不和任何酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向盐酸中滴入少量偏铝酸钠溶液:AlO2-+H++H2O=Al(OH)3↓ | |
| B. | 向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O═2HClO+SO32- | |
| C. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
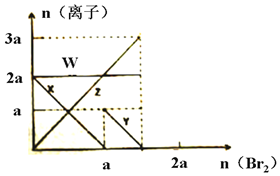 已知氧化性:Br2>Fe3+>I2,向amolFeI2和amolBaCl2的混合溶液中缓慢通入bmolBr2,并不断搅拌,溶液中离子的物质的量随Br2加入的变化如图所示(不考虑盐类水解、水的电离及溶液体积变化).则下列说法不正确的是( )
已知氧化性:Br2>Fe3+>I2,向amolFeI2和amolBaCl2的混合溶液中缓慢通入bmolBr2,并不断搅拌,溶液中离子的物质的量随Br2加入的变化如图所示(不考虑盐类水解、水的电离及溶液体积变化).则下列说法不正确的是( )| A. | 离子的还原性I->Fe2+>Br- | |
| B. | 四条线与溶液中离子的对应关系是:X-Fe2+、Y-I-、Z-Br-、W-Cl- | |
| C. | 当4a=3b时,反应后的离子浓度比:c(Fe2+):c(Fe3+)c:(Br-)=1:2:8 | |
| D. | 当3a≤2b时,发生的离子方程式:2Fe2++4I-+3Br2═2Fe3++2I2+6Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com