
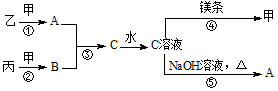
 甲、乙、丙均为中学化学常见的气体单质,A为10电子化合物,B为18电子化合物,各物质之间存在如图所示的转化关系(部分反应条件及产物略去):
甲、乙、丙均为中学化学常见的气体单质,A为10电子化合物,B为18电子化合物,各物质之间存在如图所示的转化关系(部分反应条件及产物略去): .
.分析 甲、乙、丙均为中学化学常见的气体单质,A为10电子化合物,B为18电子化合物,C溶液中加入氢氧化钠溶液加热反应生成A,判断A为氨气,C溶液中加入金属镁生成气体甲证明为H2,则乙为N2,丙为氯气,A为NH3,B为HCl,C为NH4Cl,据此分析,
(1)甲为氨气,B为HCL氢原子最外层1个电子,氯原子最外层7个电子,HCl分子是由1个氢原子和1个氯原子通过共用1对电子结合而成的共价化合物;
(2)反应⑤是铵根离子和氢氧根离子加热反应生成氨气和水;
(3)活化能越大反应速率越慢;
(4)一定条件下,向容积不变的某密闭容器中加入x mol甲和y mol乙及催化剂,发生的反应为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,
①若x=8,y=2,反应达到平衡时转移2mol电子,且反应放出30.8kJ热量,反应中电子转移6mol电子反应氮气1mol,氢气3mol,放热92.4KJ,据此书写热化学方程式,结合反应三行计算计算转化率=$\frac{消耗量}{起始量}$×100%;
②若欲使平衡时气体乙的体积分数为恒定值,氮气和氢气物质的量相同;
解答 解:(1)甲的化学式为NH3,HCl分子是由1个氢原子和1个氯原子通过共用1对电子结合而成的共价化合物其电子式为 ,
,
故答案为:NH3; ;
;
(2)反应⑤是铵根离子和氢氧根离子加热反应生成氨气和水,反应的离子方程式为:NH4++OH-=NH3•H2O,
故答案为:NH4++OH-=NH3•H2O;
(3)反应①中生成1mol A的活化能为1127kJ/mol,反应②中生成1mol B的活化能为340kJ/mol,则相同条件下,反应①的反应速率大于反应②的反应速率,故答案为:大于;
(4)一定条件下,向容积不变的某密闭容器中加入x mol甲和y mol乙及催化剂,发生的反应为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,
①若x=8,y=2,反应达到平衡时转移2mol电子,且反应放出30.8kJ热量,反应中电子转移6mol电子反应氮气1mol氢气3mol,放热92.4KJ,据此书写热化学方程式为:N2(g)+3H2(g)$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3 (g)△H=-92.4KJ/mol,结合反应三行计算计算,转移2mol电子反应的氮气物质的量为$\frac{1}{6}$mol,
N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,
起始量 2 8 0
变化量 $\frac{1}{3}$ 1 $\frac{2}{3}$
平衡量 $\frac{5}{3}$ 7 $\frac{2}{3}$
乙的转化率=$\frac{消耗量}{起始量}$×100%=$\frac{\frac{1}{3}mol}{2mol}$×100%=16.7%;
故答案为:N2(g)+3H2(g)$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3 (g)△H=-92.4KJ/mol;16.7%,
②若欲使平衡时气体乙的体积分数为恒定值,需要满足氮气和氢气物质的量相同,x=y,故答案为:x=y;
点评 本题考查了物质结构、化学反应离子方程式和热化学方程式书写、化学平衡计算等知识点,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸的反应 OH-+H+═H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| C. | CH3COOH溶液与NH3•H2O溶液反应:H++OH-═H2O | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①②③ | C. | ①⑤⑥ | D. | ②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K越大,达到平衡时,反应进行的越完全 | |
| B. | K随反应物浓度的改变而改变 | |
| C. | K越小,达到平衡时,反应物的转化率越大 | |
| D. | K不随温度的升高而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1mol•L-1的NaCl溶液 | B. | 75 mL 3 mol•L-1 NH4Cl溶液 | ||
| C. | 150 mL 2 mol•L-1的KCl溶液 | D. | 75 mL 2mol•L-1的FeCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com