
| A. | 常温常压下,11.2L氯气所含原子数目为NA | |
| B. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| C. | 标准状况下,11.2L SO3 中含有2NA个原子 | |
| D. | 用石灰乳完全吸收1 mol Cl2时,转移电子的数目是2NA |
分析 A.常温常压Vm>22.4L/mol;
B.根据Fe3O4中铁为+$\frac{8}{3}$价来分析;
C.气体摩尔体积使用对象为气体;
D.氯气与氢氧化钙反应为歧化反应,氯气既是氧化剂又是还原剂;
解答 解:A.常温常压Vm>22.4L/mol,则11.2L氯气物质的量小于0.5mol,所含原子数目小于NA,故A错误;
B.Fe3O4中铁为+$\frac{8}{3}$价,故1mol铁反应失去$\frac{8}{3}$mol电子,3mol单质Fe完全转化为Fe3O4失去8mol电子,即8NA个,故B正确;
C.标况下三氧化硫不是气体,不能使用气体摩尔体积,故C错误;
D.用石灰乳完全吸收1molCl2时,氯气既是氧化剂也是还原剂,1mol氯气反应转移了1mol电子,转移电子的数目是NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数,注意标准状况下物质的状态是否是气体,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量、气体摩尔体积的转化关系,本题难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 酒精、汽车在桌面上着火时,立即用水扑灭 | |
| B. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| C. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应立即转移到容量瓶中定容,以减小误差 | |
| D. | 用分液漏斗分液时,下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种溶液pH的大小顺序是③>②>① | |
| B. | 若将3种溶液稀释相同倍数,pH变化最大的是② | |
| C. | 若分别加入25 mL 0.1 mol/L盐酸后,pH最大的是① | |
| D. | 3种溶液中,由水产生的c(H+)大小顺序是①>③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

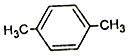 D.
D.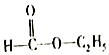
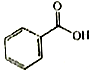 F.
F. 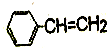 G.
G.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
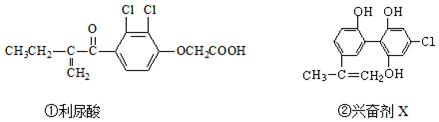
| A. | 利尿酸能发生取代反应、加成反应和酯化反应 | |
| B. | 1mol兴奋剂X与足量浓溴水反应,最多消耗3molBr2 | |
| C. | 可用FeCl3溶液检测利尿酸中是否含有兴奋剂X | |
| D. | 1mol兴奋剂X最多都能和5molNaOH的溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2 | |
| B. | 铁露置在空气中一段时间后就会生锈;性质更活泼的铝不能稳定存在于空气中 | |
| C. | 化合物NaCl的焰色为黄色;Na2CO3的焰色也为黄色 | |
| D. | 密度为1.1 g•cm-3与密度为1.2 g•cm-3的NaCl溶液等体积混合,所得NaCl溶液的密度介于1.1 g•cm-3与1.2 g•cm-3之间; Na-K合金的熔点应介于Na和K熔点之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、K+、SO42-、CO32- | B. | Na+、NO3-、Ac-、K+ | ||
| C. | Al3+、Na+、Cl-、SO42- | D. | Na+、K+、MnO4-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为河虾中含有砷元素,所以不能食用 | |
| B. | “两者同食”发生的反应中维生素C作氧化剂 | |
| C. | 五价砷在维生素C作用下发生了还原反应 | |
| D. | 已知砒霜的主要成分是氧化砷,可以推测所含的砷元素化合价为+5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com