
下列反应的离子方程式书写正确的是
①硫酸铜溶液与氢氧化钡溶液反应:Ba2++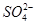 =BaSO4↓
=BaSO4↓
②将金属钠加入水中:2Na+2H2O=2Na++2OH-+H2↑
③石灰石溶于稀醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O
④氯气与水反应:Cl2+H2O=H++Cl-+HClO
⑤小苏打溶液中加入少量石灰水:Ca2++2OH-+2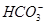 =CaCO3↓+
=CaCO3↓+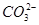 +2H2O
+2H2O
⑥次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
⑦钠与硫酸铜溶液反应:Cu2++2Na=Cu+2Na+
⑧纯碱溶液中滴加少量盐酸: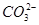 +H+=
+H+=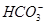
A.①②⑤ B.②③④⑤⑧ C.④⑤⑥⑦ D.②③⑧
科目:高中化学 来源:2014高考名师推荐化学速率表示与平衡移动(解析版) 题型:选择题
T ℃时在2 L的密闭容器中X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,反应温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是
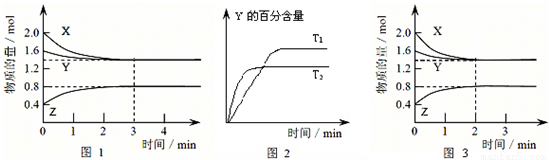 A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·(L·min)-1
A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·(L·min)-1
B.容器中发生的反应可表示为3X(g)+Y(g)  2Z(g)
2Z(g)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习1(解析版) 题型:填空题
锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。

回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:
Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是________,电解质的主要成分是______,正极发生的主要反应是________。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是_______。
(2)图(b)表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
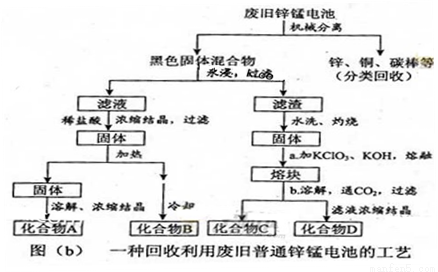
①图(b)中产物的化学式分别为A_______,B________。
②操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为_______。
③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是 。(填化学式)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子的性质及检验(解析版) 题型:填空题
有一种白色粉末,含有下列阴离子和阳离子中的几种。
阴离子:S2-、Cl-、NO、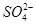 、
、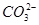 、
、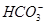 、
、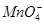 。
。
阳离子:Na+、Mg2+、Al3+、Ba2+、Fe2+、Fe3+、Cu2+、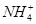 。
。
将该白色粉末进行下列实验,观察到的现象如下:
实验操作 | 现象 |
a.取少量粉末,加水、振荡 | 全部溶解、 |
溶液无色透明 |
|
b.向所得溶液中慢慢滴入苛性钠溶液,并加热 | 无明显现象 |
c.取少量粉末,加盐酸 | 无明显现象 |
d.取少量粉末,加稀H2SO4和稀HNO3的混合液 | 有白色沉淀生成 |
根据实验推断:
(1)从a实验中,可推断粉末中不可能有 (填离子符号,下同)。
(2)从b实验中,可推断粉末中不可能有 。
(3)从c实验中,可推断粉末中不可能有 。
(4)从d实验中,可推断粉末中不可能有 ,一定含有 。
(5)以上各实验仍无法确定是否存在的离子是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子的性质及检验(解析版) 题型:选择题
某澄清溶液中可能含有下列离子中的几种:Na+、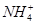 、Fe2+、Fe3+、Ba2+、
、Fe2+、Fe3+、Ba2+、 、
、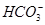 、Cl-。对其进行如下实验:①用玻璃棒蘸取该溶液滴在pH试纸上,试纸显红色;②另取少量溶液加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀;③取②中上层清液加入酸化的硝酸银溶液,也生成白色沉淀。下列关于该溶液的说法中正确的是
、Cl-。对其进行如下实验:①用玻璃棒蘸取该溶液滴在pH试纸上,试纸显红色;②另取少量溶液加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀;③取②中上层清液加入酸化的硝酸银溶液,也生成白色沉淀。下列关于该溶液的说法中正确的是
A.该溶液中一定不存在Ba2+和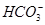
B.取③中滤液加入KSCN,溶液显血红色,则原溶液中一定有Fe3+
C.该溶液中一定存在 和Cl-
和Cl-
D.另取该溶液加入少量稀NaOH溶液,微热,试管口的湿润红色石蕊试纸不变蓝,则原溶液中一定不存在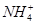
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子方程式的书写及正误判断(解析版) 题型:选择题
下列离子方程式书写正确的是
A.在100 mL浓度为1 mol·L-1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O=2Fe2++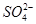 +4H+
+4H+
B.在100 mL浓度为2 mol·L-1的FeI2的溶液中通入标准状况下5.6 L的Cl2:4Fe2++6I-+5Cl2=4Fe3++3I2+10Cl-
C.向NaHCO3溶液中加入过量的澄清石灰水:2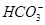 +Ca2++2OH-=CaCO3↓+2H2O+
+Ca2++2OH-=CaCO3↓+2H2O+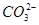
D.向明矾溶液中加入过量的氢氧化钡溶液:Al3++2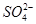 +2Ba2++4OH-=2BaSO4↓+
+2Ba2++4OH-=2BaSO4↓+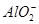 +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子大量共存与推断(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3-
B.使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3-
C.0. 1 mol·L-1AgNO3溶液:H+、K+、SO42- 、I-
D.0. 1 mol·L-1NaAlO2溶液: H+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盐类水解的概念与离子浓度大小比较(解析版) 题型:选择题
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表,下列判断不正确的是
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
A. 实验①反应后的溶液中:c(K+) > c(A—) > c(OH—) > c(H+)
B. 实验①反应后的溶液中:c(OH—) = c(K+) — c(A—) = Kw/10-9mol/L
C.实验②反应后的溶液中:c(A—) + c(HA) > 0.1 mol/L
D.实验②反应后的溶液中:c(K+) = c(A—) > c(OH—) = c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com