
| A. | Fe | B. | 胆矾 | C. | 含酚酞的碱溶液 | D. | pH试纸 |
分析 浓硫酸和稀硫酸都属于酸,都具有酸的性质,浓硫酸还具有强氧化性、脱水性、吸水性,浓硫酸稀释放出大量的热,以此来解答.
解答 解:A.Fe遇浓硫酸在常温下钝化,而稀硫酸与Fe反应生成气体,现象不同,可鉴别,故A不选;
B.浓硫酸具有脱水性,可使蓝色的硫酸铜晶体失去结晶水,而稀硫酸不能,可鉴别,故B不选;
C.二者均与碱反应,溶液变为无色,现象相同,不能鉴别,故C选;
D.浓硫酸具有脱水性,可使pH试纸变黑,而稀硫酸不能,现象不同,可鉴别,故D不选;
故选C.
点评 本题考查物质的鉴别,为高频考点,把握浓硫酸和稀硫酸的性质差异为解答的关键,注意可以采用化学方法或物理方法鉴别,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
 .
. .
. .
. 、
、 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制备氯气时用碱液吸收尾气:Cl2+OH-═Cl-+ClO-+H2O | |
| B. | 碳酸氢钠中滴加澄清石灰水:CO32-+Ca2+═CaCO3↓ | |
| C. | 大理石用盐酸溶解:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 腐蚀电路板的原理:Fe3++Cu═Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②的溶液变黄的原因是反应产生Fe3+ | |
| B. | 上述实验中,共有两个氧化还原反应 | |
| C. | 实验①生成的气体不能使湿润的淀粉KI试纸变蓝 | |
| D. | 实验②证明Fe2+既有氧化性又有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移4NA个电子 | |
| B. | 100g质量分数为98%的浓硫酸中所含有的氧原子数为4NA | |
| C. | NA个H2分子与NA个D2O分子的质量比为1:9 | |
| D. | 标准状况下,5.6g乙烯和丙烯的混合气体中含C-H键的数目为0.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅是一种半导体材料,常用于制造光导纤维 | |
| B. | 发酵粉中含有碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| C. | 铜能与氯化铁溶液反应,该反应可以应用于印刷电路板的制作 | |
| D. | 金属钠可用于冶炼钛等金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
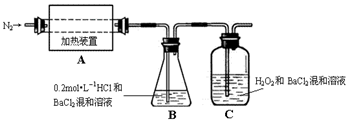
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳链是直链的烃,其含氢量是碳原子数相同的烃中最大的 | |
| B. | 相对分子质量越大的烷烃,其密度可能越大 | |
| C. | 有机物在空气中充分燃烧,各元素的最终产物分别是C→CO2,H→H2O | |
| D. | 在控制反应物和产物均为气态的条件下,分子中氢原子数为4的烃,燃烧反应前后体积不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com