

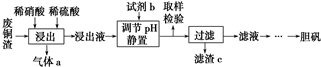
分析 NaClO3和浓H2SO4在反应器I中与二氧化硫反应生成ClO2和Na2SO4,ClO2在反应器II中与双氧水、氢氧化钠反应生成亚氯酸钠,再得到其晶体,
(1)有流程图可知“反应1”中有ClO2生成,纯ClO2易分解爆炸,通空气的目的是防爆炸;
(2)“反应2”是ClO2在碱性条件下被过氧化氢氧化得到NaClO2,可结合电子守恒及原子守恒写出此反应的化学方程式;
(3)减压蒸发在较低温度下可进行,防止温度过高而导致物质分解,洗涤时为减少损失可从降低溶解度的角度分析,可选择冷水或酒精作洗涤剂;
(4)有流程图可知,溶解氯酸钠使用了硫酸,“反应1”通SO2作还原剂,氧化产物是硫酸钠;
(5)粗产品中还含有其它可溶性盐,可结合溶解度随温度变化情况,选择分离方法.
解答 解:NaClO3和浓H2SO4在反应器I中与二氧化硫反应生成ClO2和Na2SO4,ClO2在反应器II中与双氧水、氢氧化钠反应生成亚氯酸钠,通过冷却结晶与重结晶得到其晶体,
(1)“反应1”因纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全,故答案为:稀释ClO2以防爆炸;
(2)根据生成NaClO2目标物的特点可知,反应的方程式为H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2,反应中Cl元素的化合价降低,则ClO2为氧化剂,
故答案为:H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2;
(3)减压蒸发在较低温度下可进行,防止常压蒸发温度过高,亚硫酸钠容易分解,选择冰水或酒精洗涤,可减少晶体的溶解引起的损失,8故答案为:常压蒸发温度过高,亚硫酸钠容易分解;冰水或酒精;
(4)氯酸钠与二氧化硫在酸性条件下发生氧化还原反应生成ClO2和Na2SO4,则母液中应含有Na2SO4,故答案为:Na2SO4;
(5)结合溶解度的差异,采用重结晶进行分离提纯,得到纯的亚氯酸钠晶体,故答案为:重结晶.
点评 本题考查物质的制备实验的工业设计,题目难度中等,本题注意把握物质的性质,从质量守恒的角度以及氧化还原反应的特点判断生成物,为解答该题的关键,也是易错点.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | CO2+H2O═H2CO3 | ||
| C. | Fe+H2SO4=FeSO4+H2↑ | D. | MgCO3+2HCl═2HCl2+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将CO2通过Na2O2使其增重ag时,反应中转移电子数为$\frac{a{N}_{A}}{14}$ | |
| B. | 将1molCl2通入水中,则 N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| C. | 2.24L的CH4中含有的C-H键数为0.4NA | |
| D. | 常温常压下,3.0g含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com