
已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则C物质的以下性质错误的是
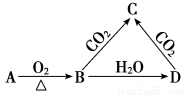
A.溶液呈碱性 B.与澄清石灰水反应产生白色沉淀
C.受热易分解 D.与足量盐酸反应放出气体
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
有4种碳架如下的烃,下列说法正确的是
a.  b.
b. 
c. 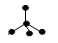 d.
d.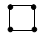
①a和d是同分异构体
②b和c是同系物
③a和b都能发生加成反应
④只有b和c能发生取代反应
A.①④ B.①② C.②③ D.①②③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二12月月考化学卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.0.1mol/LNaF溶液中所含F-数小于0.1NA
B.标准状况下,2.24L乙醇中含有的C—H键数为0.5 NA
C.0.1molNa完全被氧化生成Na2O2时,转移的电子数为0.1 NA
D.0.1mol臭氧中所含氧原子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一12月月考化学卷(解析版) 题型:选择题
关于钠的用途叙述不正确的是
A.钠用于电光源上
B.钠是一种强还原剂,可以把钛、锆、铌、钽从其熔融盐中置换出来
C.钠和钾的合金常温下为液体,可作原子反应堆的导热剂
D.工业上可用于生产纯碱和大量制备氢氧化钠
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上大考二化学卷(解析版) 题型:填空题
无水AlC l3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
l3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。

提示:2Fe(OH)3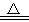 Fe2O3 + 3H2O
Fe2O3 + 3H2O
(1)铝在空气中有强的抗腐蚀性,原因是 。
(2)氯化炉中Al2O3、Cl2和C反应的化学方程式为 ________________________。
(3)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,反应完后溶液呈碱性,此反应的离子方程式为
_____________________。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.32 g。
①写出上述除杂过程中涉及的离子方程式: 、 。
②产品中AlCl3的质量分数为(只列出计算式,不计算结果) 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上大考二化学卷(解析版) 题型:选择题
反应4HNO3(浓)+Cu=Cu(NO3)2+2NO2↑+2H2O,下列说法正确的是
A.NO2是氧化产物
B.若1mol Cu完全反应,则反应中共转移了2NA个电子
C.HNO3作氧化剂,发生氧化反应
D.氧化产物和还原产物的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上调研四化学试卷(解析版) 题型:填空题
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯, 请完成该反应的化学方程式
_____C+____ KMnO4+____H2SO4→____CO2↑+_____MnSO4+ ______K2SO4+_____H2O
(2)焦炭可用于制取水煤气,测得12g碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量。
反应的热化学方程式为_________________。
(3)工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)  CH3OH(g) △H=akJ/mol 如表所列数据是反应在不同温度下的化学平衡常数(K)。
CH3OH(g) △H=akJ/mol 如表所列数据是反应在不同温度下的化学平衡常数(K)。

① 判断反应达到平衡状态的依据是___________。(填序号)
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的平均相对分子质量不变
C.混合气体的密度不变
D.CH3OH、CO、H2的浓度都不再发生变化
②某温度下,将2molCO和一定量的H2充入2L的密闭容器中,充分反应l0min后,达到平衡时测得c(CO)=0.2 mol/L,则以H2表示的反应速率v(H2)=________。
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混和气为正极助燃气,制得在650℃下的燃料电池,其正极反应式:O2+2CO2+4e-=2CO32-,则负极反应式为___________________。
(5)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层淸液,如此处理多次,可使BaSO4 全部转化为BaCO3发生反应:BaSO4(s) + CO32-(aq)=BaCO3(s) +SO42-(aq)。己知某温度下该 反应的平衡常数 K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积 Ksp=______。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上调研四化学试卷(解析版) 题型:选择题
在一种酸性溶液中,可能存在NO3-、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下推测中不正确的是
A.一定有碘离子 B.可能含铁离子 C.可能有氯离子 D.不含硝酸根离子
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上月考四化学卷(解析版) 题型:填空题
随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g) 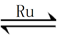 CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
已知H2的体积分数随温度升高而增加。
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α(H2) |
(2)相同温度,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/mol·L-1 | [H2]/mol·L-1 | [CH4]/mol·L-1 | [H2O]/mol·L-1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为_________。 (用含有a、b、c、d、m、n、
(用含有a、b、c、d、m、n、 x、y的一个代数式表示)
x、y的一个代数式表示)
(3)碳酸H2CO3,K1=4.3×10-7,K2=5.6×10-11,草酸H2C2O4,K1=5.9×10-2,K2=6.4×10-50.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。
若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____________。(选填编号)
A.[H+]>[HC2O4-]>[HCO3-]>[CO32-]
B.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
C.[H+]>[HC2O4-]>[C2O42-]>[CO32-]
D.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
(4)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3- H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。___________________________
H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。___________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com