
| A. | 正极反应式为:O2+4e-+2H2O=4OH- | |
| B. | 工作一段时间后,电解液中硫酸的物质的量浓度不变 | |
| C. | 通氢气的电极上发生还原反应 | |
| D. | 溶液中氢离子流向通氧气的电极 |
分析 氢氧燃料电池中,以硫酸溶液为电解质溶液,则负极上氢气失电子生成氢离子、正极上氧气得电子和氢离子反应生成水,阳离子移向正极,阴离子移向负极,据此分析解答.
解答 解:A.氢氧燃料电池中,以硫酸溶液为电解质溶液,则正极上氧气得电子和氢离子反应生成水,则反应式为:O2+4e-+4H+=2H2O,故A错误;
B.燃料电池中总反应为氢气和氧气燃烧生成水,所以电解液硫酸被稀释,则浓度减小,故B错误;
C.氢氧燃料电池中,负极上氢气失电子发生氧化反应,故C错误;
D.氢氧燃料电池中,氧气为正极,氢气为负极,阳离子移向正极,所以氢离子流向通氧气的电极,故D正确;
故选D.
点评 本题考查燃料电池电极反应式的书写,题目难度不大,电极反应式书写要结合电解质溶液酸碱性,注意酸性溶液中不能生成氢氧根离子、碱性溶液中不能生成氢离子,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应,水是氧化剂 | |
| B. | 少量钠可以保存在煤油中 | |
| C. | 钠与硫酸铜溶液反应,既有沉淀产生,又有气体生成 | |
| D. | 23g钠在空气中充分燃烧生成Na2O2时,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 氧化物 | 含氧酸 | 碱 | 盐 | |
| A | 空气 | SiO2 | H2SO4 | Na2CO3 | NaHCO3 |
| B | 冰水混合物 | Na2O | NaHSO4 | NaOH | NaCl |
| C | 水煤气 | CuO | HCl | NH3.H2O | CaF2 |
| D | 盐酸 | Na2O2 | HNO3 | Ca(OH)2 | CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
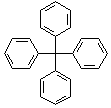 甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )
甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )| A. | 分子式为C25H20 | |
| B. | 所有碳原子可能在同一平面上 | |
| C. | 该化合物分子一定处于同一平面的原子至少有12个 | |
| D. | 分子中可能处于同一平面的原子最多有23个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl NaBr NaI | B. | NaCl NaBr | C. | NaCl NaI | D. | NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com