
下列有关实验装置进行的相应实验,能达到实验目的的是
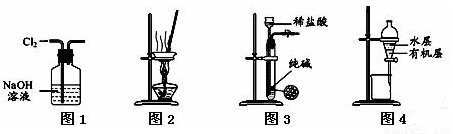
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016届内蒙古赤峰二中高三上学期12月月考理综化学试卷(解析版) 题型:简答题
尿素是蛋白质代谢的产物,也是重要的化学肥料。工业合成尿素反应如下:
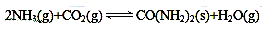
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示。
①A点的正反应速率v正(CO2)_______B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
氨气的平衡转化率为________________________。
②关于上述反应的平衡状态下列说法正确的是________________
A.分离出少量的尿素,反应物的转化率将增大
B.平衡时再充入一定量NH3 (g),CO2的转化率增大
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高尿素的产率
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(l) (氨基甲酸铵) △H1
H2NCOONH4(l) (氨基甲酸铵) △H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
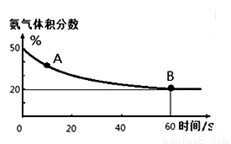
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_______步反应决定,总反应进行到 _______ min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_________ 。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2 ________0(填“>”“<”或“=”)
④第一步反应的△S ________0(填“>”、“<”或,“=”),在________(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底。将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素。此时溶液中c(NH4+)= _____________________;NH4+水解平衡常数值为______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东广州执信中学高一上期中考试化学试卷(解析版) 题型:选择题
在反应4NH3+5O2═4NO+6H2O中,下列说法正确的是
A.NH3在反应中得到电子
B.O2在反应中失去电子
C.NO是反应 的还原产物
的还原产物
D.1mol氧化剂在反应中得到4mol电子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东广州执信中学高二上期中文化学试卷(解析版) 题型:?????
碳元素可以存在于自然界的多种物质中,这些物质肯定不包括( )
A.石油 B.石灰石 C.天然气 D.石英
查看答案和解析>>
科目:高中化学 来源:2016届浙江临海台州中学高三上学期第三次统练化学试卷(解析版) 题型:选择题
已知,某无色溶液中含有下列离子中的几种:Na+、Ba2+、Br-、Cl-、SO32-、SO42-,为了确定溶液的组成,某学生进行如下探究实验:
①用pH试纸检测溶液的酸碱性,溶液的pH大于7
②取少量溶液,向其中滴加氯水,再加入CC14振荡,静置,CC14呈橙黄色
③另取少量溶液,向其中滴加Ba(NO3)2溶液和稀HNO3,有白色沉淀产生
④用分液漏斗将②所得混合液分离,倒出上层清液,滴加AgNO3溶液和稀HNO3,有白色沉淀产生。
根据上述实验判断,下列结论正确的是
A.原溶液中一定含有Br-、SO42-
B.原溶液一定含有Na+,不含Ba2+
C.实验①与上述离子的检验无关,可以省略
D.若要判断原溶液中是否含有Cl-,所需药品有CCl4溶液、Ba(NO3)2溶液和稀HNO3
查看答案和解析>>
科目:高中化学 来源:2016届云南师大附中高考适应性月考(四)理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.液态植物油通过催化加氢可制得人造奶油
B.饱和(NH4)2SO4溶液可使蛋白质变形
C.淀粉和蛋白质的组成元素相同
D.石蜡油经分馏可以获得乙烯
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三第五次模拟理科综合试卷(解析版) 题型:填空题
有A、D、E、G、M、L六种前四周期的元素。A是宇宙中最丰富的元素。D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态。G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8。L位于周期表第12纵行且是六种元素中原子序数最大的。R是由M、L形成的化合物,其晶胞结构如图所示。请回答下列问题:
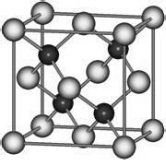
(1)E元素的电负性________M元素的电负性(填“>”、“<”或“=”)。
(2)G的第一电离能比它同周期前一族相邻元素的第一电离能________(填“大”或“小”)。
(3)E-的最外层共有______种不同运动状态的电子,最外层电子分属______个能级。M2E2广泛用于橡胶工业,在该化合物分子中,所有原子最外层均满足8电子稳定结构。则在M2E2分子中M原子的杂化类型是__________,M2E2是_________分子(填“极性”或“非极性”)。
(4)M和G形成的一种化合物分子式为MG2,该分子的VSEPR模型为__________,分子的空间构形为___________。
(5)L的价电子排布式为_________,该元素位于周期表中_____族。
(6)R的化学式为________(用元素符号表示),属于_______晶体。已知R晶体的密度为ρ g•cm-3,则该晶胞的边长a=_____________ cm,(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南二校高一理科实验班上联考2化学卷(解析版) 题型:填空题
如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的9/10,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的摩擦)
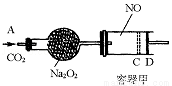
已知:2Na2O2+2CO2→2Na2CO3+O2
(1)已知当活塞移至C处时,干燥管中物质的质量增加了2.24g。
①此时,通入标准状况下的CO2气体为 L。
②容器甲中NO2转化为N2O4的转化率是 。
③活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处.则a值必 0.01(填大于、小于、等于),其理由是 。
(2)若改变干燥管中Na2O2的量,要通过调节甲容器的温度及通入的量CO2,使活塞发生从D到C,又从C到D的移动,则Na2O2的质量最小值应大于 g。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁实验中学分校高一上12月月考化学卷(解析版) 题型:选择题
下列各组物质,前者逐滴滴加到后者中直至过量,先出现白色沉淀,后来沉淀又消失的是( )
A.H2SO4滴入NaAlO2溶液中 B.Ba(OH)2溶液滴入Al2(SO4)3溶液中
C.Al2(SO4)3溶液滴入NaOH溶液中 D.氨水滴入Al2(SO4)3溶液中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com