
| A. | 乙烯水化制乙醇;溴乙烷水解制乙醇 | |
| B. | 甲苯使酸性高锰酸钾溶液褪色;丙炔和氢气反应制取丙烷 | |
| C. | 甲苯硝化制TNT;乙炔与氯化氢反应制氯乙烯 | |
| D. | 乙醇脱水制乙烯;溴乙烷脱溴化氢制乙烯 |
分析 A.乙烯水化制乙醇为加成反应;溴乙烷水解制乙醇为取代反应;
B.分别为氧化和加成反应;
C.甲苯硝化制TNT为取代反应;乙炔与氯化氢反应制氯乙烯为加成反应;
D.都属于消去反应.
解答 解:A.乙烯水化制乙醇,C=C生成C-C,为加成反应,溴乙烷水解制乙醇,-OH取代-Br,为取代反应,二者不相同,故A不选;
B.甲苯使酸性高锰酸钾溶液褪色为氧化,丙炔和氢气反应制取丙烷为加成反应,二者不同,故B不选;
C.甲苯硝化制TNT为取代反应;乙炔与氯化氢反应制取氯乙烯为加成反应,二者不同,故C不选;
D.乙醇脱水制乙烯和溴乙烷脱溴化氢制乙烯,二者都属于消去反应,生成碳碳双键,反应类型相同,故D选.
故选D.
点评 本题考查有机物反应类型,综合考查有机物官能团的性质和反应类型的判断,题目难度不大,注意把握有机物的官能团的性质.


科目:高中化学 来源: 题型:选择题
| A. | 石油主要成分都是碳氢化合物 | |
| B. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| C. | 天然气和沼气的主要成分是甲烷 | |
| D. | 75%(体积分数)的乙醇溶液常用于医疗消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4、C2H6O | B. | C2H2、C6H6 | C. | CH2O、C3H6O2 | D. | CH4、C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入NaOH的溶液,加热,冷却后加入AgNO3溶液 | |
| B. | 加入NaOH溶液,加热,冷却后加入足量稀硝酸酸化,再加入AgNO3溶液 | |
| C. | 在氯乙烷中直接加入AgNO3溶液 | |
| D. | 加蒸馏水,充分搅拌后,加入AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
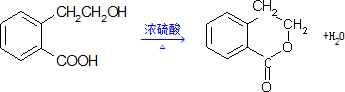 .
. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在周期表中,元素的族序数都等于其原子的最外层电子数 | |
| B. | 周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强 | |
| C. | 同主族元素随原子核电荷数的递增,原子半径依次减小 | |
| D. | 第ⅦA族元素的单质,随分子量的增大,熔、沸点逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将电石和水反应后的气体通入溴水中,如果溴水褪色,证明乙炔和溴发生了反应 | |
| B. | 实验室制溴苯时,将苯与液溴混合后加到有铁丝的反应容器中 | |
| C. | 往酸性KMnO4溶液中通入乙烯来证明乙烯有还原性 | |
| D. | 乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红葡萄酒密封储存时间越长,质量越好,原因之一是贮存过程中生成了有香味的酯 | |
| B. | 透过观察颜色容易区分黄金与铜锌合金 | |
| C. | 乙烯的产量可以用来衡量一个国家的石油化工发展水平 | |
| D. | 燃料电池是一种高效、环境友好的发电装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
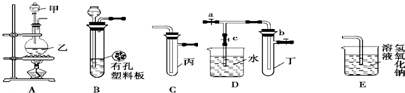
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com