
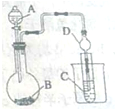
 某化学兴趣小组为探究元索性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元索性质的递变规律,设计了如下系列实验.分析 (1)由图可知仪器的名称,干燥管的球形结果可防止液体倒吸;
(2)设计实验验证氯的非金属性大于硫,则A中为浓盐酸,B中为KMn04,反应生成氯气,C中为Na2S,C中氯气与硫化钠反应生成S;
(3)要证明非金属性:C>Si,则A中为稀硫酸,B中为碳酸钠,反应生成二氧化碳,C中为硅酸钠,发发生强酸制取弱酸的反应.
解答 解:(1)由图可知仪器A的名称为分液漏斗,干燥管D的作用为可防止液体倒吸,故答案为:分液漏斗;可防止液体倒吸;
(2)设计实验验证氯的非金属性大于硫,则A中为浓盐酸,B中为KMn04,反应生成氯气,C中为Na2S,C中氯气与硫化钠反应生成S,
①B中发生KMnO4与浓盐酸反应生成氯气,反应为2KMn04+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,故答案为:2KMn04+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O;
②氯气氧化性强于硫单质,所以氯气能够与硫离子反应生成硫,C中反应的离子方程式为:S2-+Cl2═S↓+2Cl-,现象为有淡黄色沉淀生成,
故答案为:有淡黄色沉淀生成;S2-+Cl2═S↓+2Cl-;
(3)要证明非金属性:C>Si,则A中为稀硫酸,B中为碳酸钠,反应生成二氧化碳,C中为硅酸钠,发发生强酸制取弱酸的反应C中生成白色的硅酸沉淀,
故答案为:稀硫酸;硅酸钠;有白色沉淀生成.
点评 本题考查性质实验方案的设计,为高频考点,把握反应原理、实验装置的作用、元素性质与氧化还原反应、强酸制取弱酸的关系为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 自然界中没有游离的钠和铝 | |
| B. | 若铝钠合金投入水中得无色溶液,则n(Al)≤n(Na) | |
| C. | 铝钠合金投入到水中,一定有偏铝酸钠生成 | |
| D. | m g不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的能量一定高于M | |
| B. | Y的能量一定高于N | |
| C. | X和Y的总能量一定高于M和N的总能量 | |
| D. | 因该反应为放热反应,所以一定不必加热就可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数大小:X>Y | |
| B. | Xm+ 和Yn- 离子半径大小:r(Yn- )<r(Xm+) | |
| C. | 在周期表中X、Y在不同周期 | |
| D. | 在周期表中X、Y的族序数之差为:8-(m+n) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
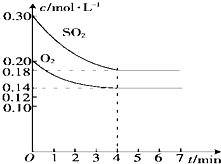 在容积为10L的密闭容器中通入一定量的SO2和O2,450℃时发生反应:2SO2+O2?2SO3(正反应放热),SO2和O2的物质的量浓度随反应时间的变化如图所示.请回答下列问题:
在容积为10L的密闭容器中通入一定量的SO2和O2,450℃时发生反应:2SO2+O2?2SO3(正反应放热),SO2和O2的物质的量浓度随反应时间的变化如图所示.请回答下列问题:| 改变的条件 | v正 | v逆 |
| ①减小SO2的浓度 | 减小 | 不变 |
| ②减小SO3的浓度 | 不变 | 减小 |
| ③缩小容器的体积 | 增大 | 增大 |
| ④加入V2O5作催化剂 | 增大 | 增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉类物质 | B. | 水 | C. | 脂肪类物质 | D. | 蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
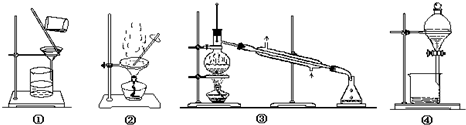
| A. | 用工业酒精制无水乙醇选择装置③ | B. | 提纯含砂石的粗苯甲酸选择装置①② | ||
| C. | 从溴水中提纯溴选择装置④ | D. | 苯中混有少量溴苯选择装置③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 4 s时容器内c(Y)=0.76 mol/L | |
| B. | 830℃达平衡时,X的转化率为80% | |
| C. | 反应达平衡后,升高温度,平衡正向移动 | |
| D. | 1200℃时反应R(g)+Q(g)?X(g)+Y(g)的平衡常数K=0.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com