
| 1 |
| 2 |
| 4×2 |
| 46+18 |
| 3×2 |
| 46+16 |
| 50×106g×92% |
| 46g/mol |


科目:高中化学 来源: 题型:
| A、全部 | B、①②⑤⑥ |
| C、②⑤ | D、①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清石灰水、浓硫酸 |
| B、KMnO4酸性溶液、浓硫酸 |
| C、溴水、浓硫酸 |
| D、浓硫酸、KMnO4酸性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
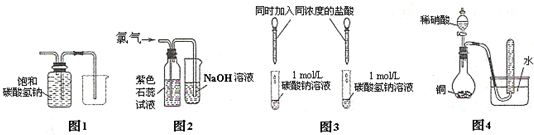
| A、①② | B、②④ | C、①④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2S溶液中c(Na+)与c(S2-)之比 |
| B、相同温度下,0.2mol/LCH3COOH溶液与0.1mol/LCH3COOH溶液中c(H+)之比 |
| C、pH等于7的氨水与硫酸铵的混合溶液中c(NH4+)与c(SO4-)之比 |
| D、pH=12的KOH溶液与pH=12的Ba(OH)2溶液中c(OH?)之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、D、E、M、N是原子序数依次增大的前四周期元素,其中X是周期表中原子半径最小的元素,Y元素基态原子的三个能级上电子数目相同,E是地壳中含量最多的元素,M是制常见不锈钢材料的第一主要合金元素,其基态原子核外的未成对电子数在同周期元素中最多,N是目前用量最大的金属元素.
X、Y、D、E、M、N是原子序数依次增大的前四周期元素,其中X是周期表中原子半径最小的元素,Y元素基态原子的三个能级上电子数目相同,E是地壳中含量最多的元素,M是制常见不锈钢材料的第一主要合金元素,其基态原子核外的未成对电子数在同周期元素中最多,N是目前用量最大的金属元素. 表示,镍原子用
表示,镍原子用 表示,镁原子用
表示,镁原子用 表示),则该晶体的化学式:
表示),则该晶体的化学式:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com