
黄铜矿(CuFeS2)是炼钢和炼铜的主要原料.在高温下灼烧生成二氰化二铁和氧化铜。三氧化二铁和氧化亚铜都是红色粉末.常用作颜料。某学校化学兴趣小组通过实验米探究一红色粉末是Fe2O3、Cu2O或两者的混合物。探究过程如下:
【查阅资料】Cu2O是一种碱性氧化物.溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
【提出假设】
假设1:红色粉末是Fe2O3。假设2:红色粉末是Cu2O。假设3:红色粉末是Fe2O3和Cu2O的混合物。
【设计探究实验】
取少量粉末放入足量稀硫酸中.在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是??????? 。
(2)滴加KSCN试剂后溶液不变红色.某同学认为原同体粉末中一定不含三氧化二铁。你认为这种说法合理吗???? 。简述你的理由(不需写出反应的化学方程式):?????????????? 。
(3)若固体粉末未完全溶解,仍然有固体存在.滴加KSCN试剂时溶液不变红色.则证明原固体粉末是??? ,写出发生的氧化还原反应的离子方程式:????? 。
【探究延伸】
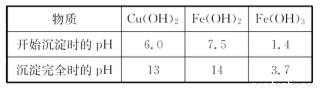
(4)经过实验分析.确定红色粉末为Fe2O3和Cu2O的混合物。实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经过查阅资料得知.在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
实验小组设汁如下实验方案:
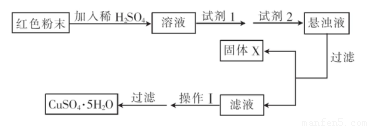
①试剂1为??? .试剂2为??????? . (填字母)
A.氯水????? B.H2O2???? C.NaOH??? D.CuO
②固体X的化学式为???????? 。
③操作II为?????????????? 。
(1)固体完全溶解,溶液呈血红色
(2)不合理;当原固体粉末为Fe2O3和Cu2O的混合物时,加入稀H2SO4后产生的Fe3+与Cu反应生成Fe2+,滴加KSCN溶液后也可能不变红色
(3)Fe2O3和Cu2O;Cu2O+2H+=Cu + Cu2++ H2O、2Fe3++Cu=2Fe2++Cu2+
(4)①B;D?? ②Fe(OH)3????? ③蒸发浓缩、冷却结晶
【解析】
试题分析:(1)取少量粉末放入足量稀硫酸中.Fe2O3与硫酸发生反应:Fe2O3+3H2SO4=Fe2(SO4)3+H2O.反应后产生了Fe3+。在所得溶液中再滴加KSCN试剂,会看到固体完全溶解,溶液呈血红色。(2)滴加KSCN试剂后溶液不变红色.某同学认为原同体粉末中一定不含三氧化二铁。这种说法是错误的,因为当原固体粉末为Fe2O3和Cu2O的混合物时,加入稀H2SO4后产生的Fe3+与Cu反应生成Fe2+,滴加KSCN溶液后也可能不变红色。(3)若固体粉末未完全溶解,仍然有固体存在.滴加KSCN试剂时溶液不变红色.则证明原固体粉末是Fe2O3和Cu2O,发生的氧化还原反应的离子方程式为Cu2O+2H+=Cu + Cu2++ H2O、2Fe3++Cu=2Fe2++Cu2+。(4)①将含有Fe2O3和Cu2O的混合物用硫酸溶解,发生反应Cu2O+2H+=Cu + Cu2++ H2O、2Fe3++Cu=2Fe2++Cu2+,由于Fe(OH)2和Cu(OH)2沉淀的PH很接近,不容易分离、提纯。而Fe(OH)3沉淀的PH较小,二者差别较大,溶液分离。所以再向该溶液中加入H2O2把Fe2+氧化为Fe3+,再加入CuO调节溶液的PH至3.7左右,Fe3+完全转化为Fe(OH)3沉淀除去。滤液的主要成分为CuSO4,再将溶液蒸发浓缩、冷却结晶,然后过滤即得到较纯净的胆矾(CuSO4·5H2O)。
考点:考查胆矾(CuSO4·5H2O)的制取方法。主要涉及的知识有物质成分的确定、Fe3+的检验、杂质的除去、混合物的分离、物质的提纯、化学方程式、离子方程式的书写等知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp | 8.0×10-16 | 2.2×-20 | 4.0×10-38 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com