
| A. | 镁元素在元素周期表中位于第三周期、第ⅡB族 | |
| B. | 第②步洗涤完毕后向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净 | |
| C. | 在工业生产上可用NaOH溶液代替石灰乳 | |
| D. | 步骤⑤也可以采用电解该晶体水溶液的方法 |
分析 从海水中提取镁操作步骤为:海水$\stackrel{加入石灰乳}{→}$Mg(OH)2↓$\stackrel{过滤洗涤沉淀物}{→}$Mg(OH)2↓$\stackrel{加入盐酸、结晶、过滤}{→}$MgCl2$\stackrel{在HCl热气流中干燥}{→}$MgCl2$\stackrel{电解}{→}$Mg,再结合题意:镁元素在元素周期表中位于第三周期、ⅡA族;洗涤是洗去沉淀表面的可溶物即Ca2+,检验是否洗涤干净可用碳酸钠溶液,看是否有沉淀出现;MgCl2是一种强酸弱碱盐,为了防止Mg2+的水解需要在氯化氢热气流中干燥;根据电解时电极的放电顺序,如果电解MgCl2的水溶液,将得到氯气和氢气等知识解决.
解答 解:A.镁核外有三个电子层、最外层有2个电子,因此镁元素在元素周期表中位于第三周期、ⅡA族,故A错误;
B.从海水中提取操作步骤为:海水$\stackrel{加入石灰乳}{→}$Mg(OH)2↓$\stackrel{过滤洗涤沉淀物}{→}$Mg(OH)2↓$\stackrel{加入盐酸、结晶、过滤}{→}$MgCl2$\stackrel{在HCl热气流中干燥}{→}$MgCl2$\stackrel{电解}{→}$Mg,将得到的沉淀物进行洗涤,是洗去沉淀表面的可溶物,结合步骤中的关系,沉淀物中含有的应为Ca2+,所以向滤液中加入碳酸钠溶液,如果有沉淀出现则未洗涤干净,反之则已经洗涤干净,故B正确;
C.石灰乳可就地取材,且材料来源广泛,若用氢氧化钠代替,制取氢氧化钠需消耗电能,工业生产经济效益不理想,故C错误;
D.根据电解的原理,当电解水溶液时,在阴阳两极分别生成氢气和氯气,而得不到镁,故D错误;
故选B.
点评 本题考查了从海水中提取镁,要将每一步的关系分析清楚,同时与其它知识结合在一起,注意从海水中提取镁操作步骤原理,题目难度中等.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:解答题
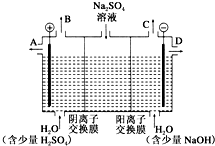 芒硝化学式为Na2SO4•10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
芒硝化学式为Na2SO4•10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氯化铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3 | |
| B. | 在澄清石灰水中通入过量CO2:OH-+CO2=HCO3- | |
| C. | 在碳酸氢钙溶液中加入过量NaOH溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| D. | 碳酸钡中加入稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过渡元素全部都是副族元素 | |
| B. | 短周期共有32 种元素 | |
| C. | 科学研究时,经常在过渡元素中寻找耐高温、耐腐蚀的合金材料 | |
| D. | 元素周期表共七个横行代表七个周期,18 个纵横代表18 个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
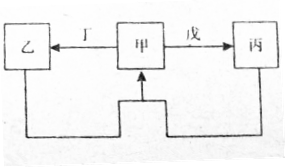
| A. | 假设:甲为Al(OH)3;结论:丁可能是盐酸 | |
| B. | 假设:甲为Na2CO3溶液;结论:戊可能是CO2 | |
| C. | 假设:甲为Fe;结论:丁可能是盐酸 | |
| D. | 假设:甲为N2;结论:戊可能是氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
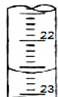 Ⅰ:某学生用0.20mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
Ⅰ:某学生用0.20mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:| 滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com