
| A. | 3.2gO2和O3混合气体所含的氧原子总数为0.2NA | |
| B. | 一定条件下,2 mol SO2和1mol O2在密闭容器中充分反应后,容器内气体分子总数为2NA | |
| C. | 12g金刚石含4NA个C-C键 | |
| D. | 0.1 mol Na在空气中完全燃烧生成Na2O2,转移的电子数为0.2NA |
分析 A.氧气和臭氧都是由氧原子构成;
B.二氧化硫与氧气反应为可逆反应,不能进行到底;
C.每个C原子与其他4个C原子共用4个C-C键,相当于每个C原子占有4×$\frac{1}{2}$=2个C-C键;
D.钠反应生成过氧化钠,化合价升高为+1价.
解答 解:A.3.2gO2和O3混合气体所含的氧原子的个数为:$\frac{3.2g}{16g/mol}$×NA=0.2NA,故A正确;
B.二氧化硫与氧气反应为可逆反应,不能进行到底,一定条件下,2 mol SO2和1mol O2在密闭容器中充分反应后,容器内气体分子总数大于2NA,故B错误;
C.每个C原子与其他4个C原子共用4个C-C键,相当于每个C原子占有4×$\frac{1}{2}$=2个C-C键,1mol金刚石含2NA个C-C键,故C错误;
D.钠反应生成过氧化钠,化合价升高为+1价,所以0.1 mol Na在空气中完全燃烧生成Na2O2,转移的电子数为0.1NA,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
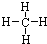
 已知A、B、C、D、E、F是中学化学中常见的六中有机物,它们的转化关系如图所示(部分物质已省略).其中A是一种生物生长调节剂,E具有水果香味,F是一种可制成多种包装材料的高分子化合物.
已知A、B、C、D、E、F是中学化学中常见的六中有机物,它们的转化关系如图所示(部分物质已省略).其中A是一种生物生长调节剂,E具有水果香味,F是一种可制成多种包装材料的高分子化合物. CH3COOC2H5+H2O;⑤nCH2=CH2$\stackrel{催化剂}{→}$
CH3COOC2H5+H2O;⑤nCH2=CH2$\stackrel{催化剂}{→}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 | LA | 0 | ||||||
| 周期 | ||||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
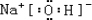
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的液化和气化都是化学变化 | |
| B. | 硝化反应和酯化反应都属于取代反应 | |
| C. | 石油的分馏和裂化都是化学反应 | |
| D. | 乙烯与溴和水的反应都属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、ClO-、Cl2三种微粒只具有氧化性,没有还原性 | |
| B. | Cl2具有强氧化性,可以把水中的氧置换出来 | |
| C. | 因为SO2具有还原性,所以与氯水可以反应生成H2SO4和HCl | |
| D. | Cl2转变为HClO时一定需要加入氧化剂才能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1s | B. | 2.5s | C. | 5s | D. | 10s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
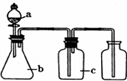 如图各相应一起中加入的试剂,可用于制取、净化、收集的气体是( )
如图各相应一起中加入的试剂,可用于制取、净化、收集的气体是( ) | 选项 | 气体 | a | b | c |
| A | H2 | 稀硫酸 | 锌粒 | 浓硫酸 |
| B | Cl2 | 浓盐酸 | 高锰酸钾 | 浓硫酸 |
| C | C2H2 | 饱和食盐水 | 电石 | 硫酸铜溶液 |
| D | O2 | 过氧化氢溶液 | 二氧化锰 | 碱石灰 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
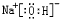 、
、 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=7的NH4Cl和NH3•H2O的混合溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | pH=12的氨水与pH=2的盐酸等体积混合溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | 25℃时,0.1 mol•L-1pH=4.5的NaHSO3溶液中:c(HSO3-)>c(H2SO3)>c(SO32-) | |
| D. | 常温下,等浓度的CH3COONa和CH3COOH混合溶液:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com