
【题目】二元化合物X可由单质硫和Ca(OH)2浊液共热制得。取一定量X与100 mL 0.2 mol·L1稀硫酸恰好完全反应,生成0.08 mol淡黄色沉淀和0.448 L气体甲(已折算为标准状况)。请回答:
(1) 甲的电子式为________。
(2) X的化学式为________。
(3) X与稀硫酸反应的化学方程式为________。
(4) 单质硫和Ca(OH)2浊液制X时,还生成另一种含氧酸盐(M<160 g·mol 1),该盐与稀硫酸反应也有淡黄色沉淀生成并放出刺激性气味气体,则单质硫与Ca(OH)2浊液反应制X的化学方程式为________。
(5) 气体甲通入硫酸铁溶液中能发生反应。请设计实验方案验证反应后溶液中除H+之外的阳离子________。
【答案】![]() CaS5或S5Ca CaS5+H2SO4=CaSO4+4S↓+H2S↑ 12S+3Ca(OH)2=2CaS5+CaS2O3+3H2O 取反应后溶液分成两份,一份滴加KSCN溶液,若溶液显血红色,则说明有Fe3+;另一份(加热使过量的H2S逸出)滴加酸性KMnO4溶液,若紫色褪去或变浅,则说明有Fe2+
CaS5或S5Ca CaS5+H2SO4=CaSO4+4S↓+H2S↑ 12S+3Ca(OH)2=2CaS5+CaS2O3+3H2O 取反应后溶液分成两份,一份滴加KSCN溶液,若溶液显血红色,则说明有Fe3+;另一份(加热使过量的H2S逸出)滴加酸性KMnO4溶液,若紫色褪去或变浅,则说明有Fe2+
【解析】
二元化合物X可由单质硫和Ca(OH)2浊液共热制得,应含有钙元素和硫元素,取一定量X与100 mL 0.2 mol·L1稀硫酸恰好完全反应,生成0.08 mol淡黄色沉淀为硫,和0.448 L气体甲为硫化氢,假设X中硫元素的化合价为-x价,反应中生成硫单质,化合价升高x价,生成硫化氢,硫的化合价降低2-x,根据硫和硫化氢的物质的量比分析,有4x=2-x,解x=0.4,则X的化学式为CaS5或S5Ca。
(1).硫化氢的电子式为: ![]() ;
;
(2)根据以上分析可知X为 CaS5或S5Ca;
(3)根据题意CaS5和硫酸反应生成硫酸钙和硫和硫化氢,方程式为: CaS5+H2SO4=CaSO4+4S↓+H2S↑ ;
(4) 另一种含氧酸盐(M<160 g·mol 1),该盐与稀硫酸反应也有淡黄色沉淀生成并放出刺激性气味气体二氧化硫,说明该物质为CaS2O3,则硫和氢氧化钙的方程式为:12S+3Ca(OH)2=2CaS5+CaS2O3+3H2O;
(5)硫化氢和硫酸铁反应生成硫和硫酸亚铁和硫酸,溶液中的阳离子除了氢离子外,还有亚铁离子,可能有铁离子,所以利用铁离子遇到硫氰化钾显红色检验,利用亚铁离子能使高锰酸钾溶液褪色碱性,实验方法为:取反应后溶液分成两份,一份滴加KSCN溶液,若溶液显血红色,则说明有Fe3+;另一份(加热使过量的H2S逸出)滴加酸性KMnO4溶液,若紫色褪去或变浅,则说明有Fe2+。


科目:高中化学 来源: 题型:
【题目】mA(g)+nB(g) ![]() pC(g)+qQ(g)当m、n、p、q为任意整数时,达到平衡的标志是:( )
pC(g)+qQ(g)当m、n、p、q为任意整数时,达到平衡的标志是:( )
①体系的压强不再改变 ②体系的温度不再改变 ③各组分的浓度不再改变 ④各组分的质量分数不再改变⑤反应速率VA:VB:VC:VD=m:n:p:q ⑥单位时间内m mol A断键反应,同时p mol C也断键反应
A. ③④⑤⑥ B. ②③④⑥ C. ①③④⑤ D. ①③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在容积固定为2 L的密闭容器内充入1 mol N2和3 mol H2合成NH3。恒温下开始反应,并用压力传感器测定压强如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
下列说法不正确的是
A.不断地将NH3液化并移走,有利于反应正向进行
B.其它条件不变,在30 min时,若压缩容器的体积,N2的平衡转化率增大
C.从反应开始到10 min时,v(NH3)=0.035 mol·L1·min1
D.在30 min时,再加入0.5 mol N2、1.5 mol H2和2 mol NH3,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】GaAs 晶体的熔点很高,硬度很大,密度为ρ gcm-3,Ga和 As的摩尔质量分别为 MGa gmol-1 和 MAsgmol-1,原子半径分别为 rGa pm 和 rAs pm,阿伏加德罗常数值为 NA,其晶胞结构如图所示,下列说法错误的是
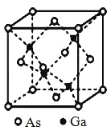
A.该晶体为共价晶体
B.该晶体中 Ga 和 As 均无孤对电子,Ga 和 As 的配位数均为 4
C.原子的体积占晶胞体积的百分率为![]()
D.所有原子均满足 8 电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、硫、硒等元素的单质及其化合物有重要的科学研究价值。回答下 列问题:
(1)氰[化学式(CN)2]、硫氰[化学式(SCN)2]等与卤素单质性质相似,又称类卤素。(CN)2 中π键和σ键的数目之比为__________。沸点:(CN)2__________ (SCN)2(填“大于”、“等于”或“小于”),理由是__________。
(2)无机含氧酸的通式可写成(HO)mROn,如果成酸元素 R 相同,则 n 值越大,R 的正电性越高,在水中越容易电离出 H+。酸性强弱:HNO2____________HNO3(填“大于”、“等于”或“小于”);NO2-中氮原子的杂化方式为___________。
(3)一种硒单质晶体的晶胞为六方晶胞,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶 体结构图和晶体结构俯视图如下所示。

已知正六棱柱的边长为 a cm,高为 b cm,NA 表示阿伏加德罗常数,则该晶体的密度为__________g·cm-3(用含 NA、a、b 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是CsCl晶体的晶胞(晶体中最小的重复单元)已知晶体中2个最近的Cs+核间距离为acm,氯化铯的式量为M,NA为阿伏加德罗常数,则CsCl晶体的密度为(单位:g/cm)
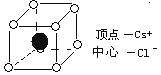 ( )
( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
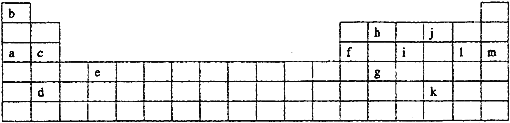
如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
A.原子核对核外电子的吸引力 B.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
锂 | X | Y | |
失去第一个电子 | 519 | 502 | 580 |
失去第二个电子 | 7296 | 4570 | 1820 |
失去第三个电子 | 11799 | 6920 | 2750 |
失去第四个电子 | 9550 | 11600 |
(1)通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量_______________________________;
(2)表中X可能为以上13种元素中的______(填写字母)元素。用元素符号表示X和j形成化合物的化学式________;
(3)Y是周期表中_______族元素;
(4)以上13种元素中,_____(填写字母)元素原子失去核外第一个电子需要的能量最多。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在离子晶体中,阴阳离子按一定规律在空间排列,如图(1)所示即是NaCl的晶体结构,这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)在晶体中,每个Na+离子周围与它最接近的、且距离相等的Cl-共有_________个;
每个Na+离子周围与它最接近的、且距离相等的Na+共有__________个。而Na+离子数目与Cl-离子数目之比为______________。
在离子晶体中,阴阳离子具有球对称的电子云。它们可以被看成是不等径的刚性圆球,并彼此相切(如图⑵所示)。离子键的键长是相邻阴阳离子的半径之和(如图⑶所示),已知a为常数。

试回答下列问题:
(2)NaCl晶体中离子键的键长为______________________。Na+离子半径与Cl-离子半径比r+/r- =____________。(已知 √2=1.414 , √3=1.732, √5=2.236)
(3)NaCl晶体中不存在分子,但在温度达到1413℃时,NaCl晶体形成气体,并以分子形式存在,现有29.25gNaCl晶体,强热使温度达到1450℃,测得气体体积为5.6L(已折算为标准状况),则此时氯化钠气体的分子式为_______________________。
(4)纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰好等于氯化钠晶胞的大小和形状,则这种纳米颗粒的表面原子占总原子数的百分数为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钍![]() Th的原子可发生下列放射性变化:
Th的原子可发生下列放射性变化: ![]() Th→
Th→![]() X+
X+![]() He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是
He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是
A. X的氢氧化物是一种强碱B. X元素位于第六周期
C. X的碳酸盐难溶于水D. X的最高化合价为+2价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com