
【题目】有下列三种物质①乙醇、②碳酸、③水,它们与钠反应产生氢气的速率由大到小的顺序是( )
A. ①>②>③B. ②>①>③C. ③>①>②D. ②>③>①
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】治理氮氧化物(NOx)的污染是化学研究的重要课题之一。
I.NO能被灼热的铁粉还原为N2,同时生成FeO,利用下列装置模拟该反应。

已知:①浓硝酸可氧化NO;②NaOH溶液能与NO2反应,不与NO反应。
(1)上述装置接口的连接顺序为a→__________(按气流方向,用小写字母表示)。
(2)装置D的作用是___________________。
(3)装置E中反应的化学方程式为___________________。
(4)打开分液漏斗活塞,烧瓶中观察到的实验现象有_____________________。
II.实验室常用NaOH溶液吸收多余的氮氧化物(NOx):NO+NO2+2NaOH=2NaNO2+H2O。设计实验验证产物NaNO2既有氧化性又有还原性。
限选试剂:稀硫酸、KI-淀粉溶液、双氧水、酸性KMnO4溶液
(5)取适量NaNO2溶液,加入_____________,观察到_____________现象,证明其具有氧化性。
(6)参照(5),设计实验证明NaNO2有还原性________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某人设计的糖厂甘蔗渣利用方案如下图所示:

其中:A能催熟水果,B是高分子化合物,D是有水果香味的物质。请回答以下问题:
(1)“C6H12O6”所示的物质的名称是_________,A的电子式为_______________。
(2)写出下列转化的化学方程式并指出反应类型:
①A→B __________________________,反应类型__________________。
②C→D_________________________,反应类型__________________。
③CH3CH2OH→CH3CHO:________________,反应类型__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低碳经济是以低能耗、低污染、低排放为基础的经济模式。低碳经济的概念在中国正迅速从高端概念演变成全社会的行为,在新能源汽车、工业节能等多个领域都大有作为。 请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)工业上可利用CO或CO2来制备清洁液体燃料甲醇。已知:800℃时,化学反应①、反应②对应的平衡常数分别为2.5、1.0。
反应①:2H2(g)+CO(g)![]() CH3OH(g) △H = -90.8kJ mol-1
CH3OH(g) △H = -90.8kJ mol-1
反应②:H2(g)+CO2(g)![]() H2O(g)+CO(g) △H= +41.2kJ mol-1
H2O(g)+CO(g) △H= +41.2kJ mol-1
写出用CO2与H2反应制备甲醇的热化学方程式________________________,800℃时该反应的化学平衡常数K的数值为_______________。
现将不同量的CO2 (g)和H2(g)分别通入到容积为2L恒容密闭容器中进行反应②,得到如下二组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO2 (g) | H2(g) | H2(g) | CO2 (g) | |||
1 | 900 | 4 | 6 | 1.6 | 2.4 | 2 |
2 | 900 | a | b | c | d | t |
实验2中,若平衡吋,CO2 (g)的转化率小于H2(g),则a、b必须满足的关系是_________。
若在900℃时,另做一组实验,在此容器中加入10mol CO2,5mol H2,2 mol CO,5 mol H2O (g),则此时v正___v逆(填“>”、“>”或“=”)。
(2)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:CH3OH(g)+CO(g) ![]() HCOOCH3(g) △H=-29.1KJ·mol-1 ,科研人员对该反应进行了研究,部分研究结果如下:
HCOOCH3(g) △H=-29.1KJ·mol-1 ,科研人员对该反应进行了研究,部分研究结果如下:
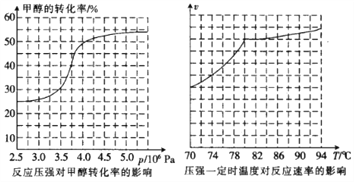
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是____(填“3.5×106 Pa”“4.0×106 Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是______________________。
(3)已知常温下NH3H2O的电离平衡常数K= 1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2 =4. 7×10-11。常温下,用氮水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液呈_____(填“酸性”“中性”或“碱性”),溶液中离子浓度由大到小的顺序为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为苯和溴的取代反应的实验装置图,其中A为由具支试管制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑粉。
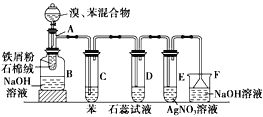
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应,写出A中所发生反应的化学方程式(有机物写结构简式):_____________________,
(2)试管C中苯的作用是___________________________。反应开始后,观察D和E两试管,看到的现象为D中_________________,E中________________。
(3)反应2~3min后,在B中的NaOH溶液里可观察到的现象是___________________。
(4)在上述整套装置中,具有防倒吸作用的装置有______________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于纯净物,混合物,强电解质,弱电解质和非电解质的正确组合是
纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
A | 纯盐酸 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
B | 冰醋酸 | 空气 | 硫酸钡 | 亚硫酸 | 二氧化硫 |
C | 氯气 | 盐酸 | 苛性钠 | 氢硫酸 | 碳酸钙 |
D | 漂白粉 | 氨水 | 氯化钠 | 次氯酸 | 氯气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2与SO2能发生反应:NO2+SO2![]() SO3+NO,某研究小组对此进行相关实验探究。
SO3+NO,某研究小组对此进行相关实验探究。
(1)硝酸厂向大气中排放NO2造成的环境问题是_______________。
(2)为了减少SO2的排放,将含SO2的烟气通过洗涤剂X,充分吸收后再向吸收后的溶液中加入稀硫酸,既可以回收SO2,同时又可得到化肥。上述洗涤剂X可以是______(选填序号)。
a.Ca(OH)2 b.K2CO3 c.Na2SO3 d.NH3·H2O
(3)实验中,尾气可以用碱溶液吸收。NaOH溶液吸收NO2时,发生的反应为:2NO2+2OH-=NO2-+NO3-+H2O,反应中形成的化学键是___________(填化学键的类型)。用NaOH溶液吸收少量SO2的离子方程式为____________。
(4)已知:2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0kJ·mol-1
2NO2(g) △H=-113.0kJ·mol-1
2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6kJ·mol-1
2SO3(g) △H=-196.6kJ·mol-1
则NO2(g)+SO2(g)![]() SO3(g)+NO(g) △H=_______。
SO3(g)+NO(g) △H=_______。
(5)在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2):n0(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率以[a(NO2)]。部分实验结果如图所示:
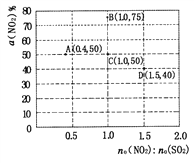
①如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是_________;
②若A点对应实验中,SO2(g)的起始浓度为c0 mol·L-1,经过t min达到平衡状态,该时段化学反应速率v(NO2)= ____mol·L·min-1;
③图中C、D两点对应的实验温度分别为Tc和Td,通过计算判断:Tc_____ Td (填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素的叙述正确的是( )
A. 金属元素与非金属元素能形成共价化合物
B. 只有在原子中,质子数才与核外电子数相等
C. 目前使用的元素周期表中,最长的周期含有36种元素
D. 非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使1.0体积的某气态烷烃和烯烃的混合气体在足量空气中完全燃烧,生成2.0体积的二氧化碳和2.2体积的水蒸气(均在120℃、1.01×105Pa条件下测定),则混合气体中烷烃和烯烃的体积比为
A. 2:3 B. 1:4 C. 4:1 D. 3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com