
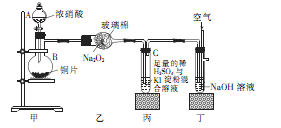

| 装置编号 | 实验现象 | 反应的化学方程式 | NO2表现的化学性质 |
| 乙 | | | 还原性(1分) |
| 丙 | 溶液变蓝色(1分) | NO2+2KI+H2SO4=K2SO4+I2+NO+H2O(3分) | |
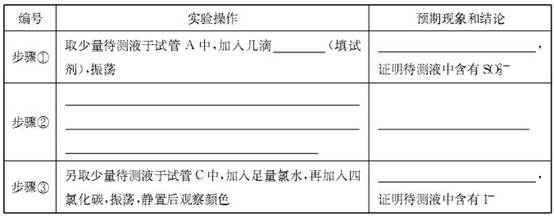
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 新制饱和溴水(1分) | 溴水褪色(1分) |
| 步骤② | 另取少量待测液于试管B中,加入过量的2 mol·L-1的盐酸,再滴加适量1 mol·L-1的 BaCl2溶液(1分) | 产生白色沉淀,证明含有SO42-(1分) |
| 步骤③ | | 溶液分层,下层液体呈紫红色(1分) |


科目:高中化学 来源:不详 题型:实验题
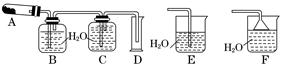
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
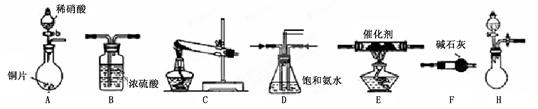
| 试剂组合序号 | 固体试剂 | NH3体积(mL) | |
| a | 6.0 g Ca(OH)2(过量) | 5.4 g NH4Cl | 1344 |
| b | 5.4g (NH4)2SO4 | 1364 | |
| c | 6.0 g NaOH(过量) | 5.4 g NH4Cl | 1568 |
| d | 5.4g (NH4)2SO4 | 1559 | |
| e | 6.0 g CaO(过量) | 5.4 g NH4Cl | 1753 |
| f | 5.4 g (NH4)2SO4 | 1792 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
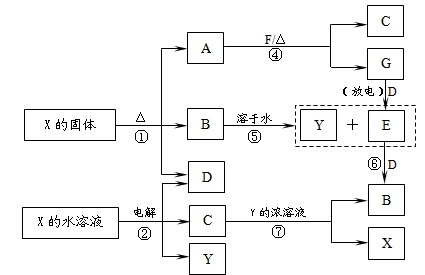
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
| B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
C.N2(g)+3H2(g) 2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大 2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大 |
| D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的ΔS<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.50.8 g | B.66.4 g | C.44.8g | D.39.2g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.5.76 | B.2.88 | C.1.44 | D.4.32 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
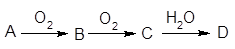
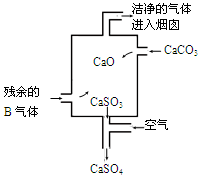
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu + HNO3(稀) | B.N2 + O2 | C.NH4Cl + O2 | D.NO2 + H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com