
| A. | NaA+H2B→NaHB+HA | B. | 2NaA+H2B→Na2B+2HA | ||
| C. | NaHB+HA→NaA+H2B | D. | Na2B+HA→NaHB+NaA |
分析 电离平衡常数越大,酸性越强,根据K1>KHA>K2可知,酸性强弱为:H2B>HA>HB-,然后结合强酸制取弱酸原理分析.
解答 解:根据K1>KHA>K2可知,酸性强弱为:H2B>HA>HB-,
A.反应NaA+H2B→NaHB+HA中酸性H2B>HA,满足条件,故A不选;
B.反应2NaA+H2B→Na2B+2HA中酸性:HA<HB-,与实际HA>HB-不相符,该反应不能进行,故B选;
C.NaHB+HA→NaA+H2B中酸性H2B<HA,与实际H2B>HA不相符,故C选;
D.反应Na2B+HA→NaHB+NaA中,酸性HA>HB-,与实际相符,故D不选;
故选BC.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,根据电离平衡常数正确判断酸性强弱为解答关键,注意掌握强酸制取弱酸原理,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
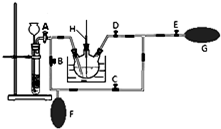 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH $\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O;K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3.
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH $\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O;K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一周期元素的原子,半径越小越容易失去电子 | |
| B. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| C. | 若M+和R2-的核外电子层结构相同,则原子序数:R<M | |
| D. | 主族元素的最高正化合价等于该元素原子的核外电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 、丙
、丙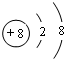 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | X有多种同素异形体,而Y不存在同素异形体 | |
| B. | 由Z与Y组成的物质在熔融时能导电 | |
| C. | 单质的沸点:W<Q | |
| D. | 钠与Y可能形成Na2Y2化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,有关该元素的说法中,错误的是( )
,有关该元素的说法中,错误的是( )| A. | 原子的核内质子数为17 | B. | 原子的核外有3个电子层 | ||
| C. | 原子的最外层电子数为7 | D. | 属于金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,1 molN2与足量的氢气反应合成氨,转移的电子数为6 NA | |
| B. | 常温下,1.0LpH=13的氢氧化钡溶液中OH-的数目为0.2NA | |
| C. | 常温常压下,4.6 g的NO2和N2O4混合物中,含原子总数一定为0.3NA | |
| D. | 1L0.1mol/L Na2CO3溶液中含CO32-数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com