
【题目】某短周期主族元素的原子A,核外共有n个电子层(n>2),则(n-1)层所能容纳的电子数为( )
A. 8个B. 18个C. 32个D. 2个
科目:高中化学 来源: 题型:
【题目】(1)二水合草酸镓的结构如图所示,其中镓原子在周期表中的位置为__________,草酸根中碳原子的杂化方式为__________。

(2)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,其中“亚铁”是关键成分,K3[Fe(CN)6]溶液是检验 Fe2+的试剂,1mol CN-中含 π 键的数目为______ ,临床建议服用维生素 C 促进“亚铁”的吸收,避免生成 Fe3+,从原子结构角度来看,Fe2+易被氧化成 Fe3+的原因是___________。
(3)化合物(CH3)3N 与盐酸反应生成[(CH3) 3NH]+,该过程新生成的化学键为______(填序号)
a. 离子键 b. 配位键 c. 氢键 d. 非极性共价键
若化合物(CH3)3N 能溶于水,试解析其原因____________________。
(4)Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。试推断 Ni2+的水合离子为 __________(填“有”或“无”)色离子,依据是_____________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
(5)元素铜与镍的第二电离能分别为:ICu=1959kJ·mol-1、INi=1753kJ·mol-1,ICu>INi的原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨为重要化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g) +H2O(g)![]() CO(g)+3H2(g) △H= +216.4 kJ /mol
CO(g)+3H2(g) △H= +216.4 kJ /mol
b.CO(g) +H2O(g) ![]() CO2(g)+H2(g) △H =-41.2 kJ/mol
CO2(g)+H2(g) △H =-41.2 kJ/mol
则反应CH4(g) +2H2O(g)![]() CO2(g)+4H2(g) △H=_________。
CO2(g)+4H2(g) △H=_________。
(2)起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度关系如下图。

①恒压时,反应一定达到平衡状态的标志是______(填序号);
A.N2和H2的转化率相等 B.反应体系密度保持不变
C.c(H2)/c(NH3) 比值保持不变 D.c(NH3)/c(N2) 等于2
②P1_____P2 (填“ > ”、“< ”、“=”,下同);反应平衡常数:B点____D点;
③在A、B两点条件下,该反应从开始到平衡时生成氨气平均速率:υ(A)______ υ(B)。
(3)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO 反应生成N2H4的化学方程式__________;
②已知25℃时N2H4水溶液呈弱碱性:
N2H4+H2O![]() N2H5++OH- K1= 1×10-a;
N2H5++OH- K1= 1×10-a;
N2H5++H2O![]() N2H62++OH- K2=1×10-b。
N2H62++OH- K2=1×10-b。
25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围_________(用含a、b式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下关于元素周期表的结构叙述正确的是
A.有七个主族,八个副族
B.有三个长周期(均含18种元素),三个短周期(均含8种元素)
C.零族位于元素周期表的第18列(从左往右)
D.第ⅢA族位于元素周期表的第三列(从左往右)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤是重要能源。燃煤会释放SO2、CO等有毒气体。消除有毒气体的研究和实践从未停止。完成下列填空:
I.用CaSO4消除CO。CaSO4和CO可发生如下两个反应:
反应①:CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g)+175.6kJ
CaS(s)+4CO2(g)+175.6kJ
反应②:CaSO4(s)+4CO(g)![]() CaO(s)+SO2(g)+CO2(g)—218.4kJ
CaO(s)+SO2(g)+CO2(g)—218.4kJ
(1)写出反应①的平衡常数表达式:_____________;一定条件下的密闭容器中,两反应均达平衡后,若使反应①K的减小,需要改变的反应条件是______________,则反应②的K___________(选填编号)、反应①的v(CO2)正__________(选填编号)。
a. 增大 b. 减小 c. 不变 d. 无法判断
(2)补全下图中反应②的能量变化示意图_______________(即,注明生成物能量的大致位置及反应热效应数值)

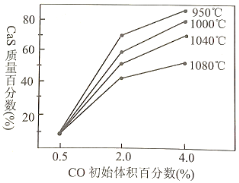
(3)下图是不同温度下,CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。写出两种降低SO2生成量的措施___________________________________。
II. Fe2(SO4)3溶液可除去煤中以黄铁矿(FeS2)形式存在的硫元素,反应如下:8H2O + FeS2+ 7Fe2(SO4)3→15FeSO4+ 8H2SO4
(4)标出电子转移的数目和方向________;还原产物是_______。
(5)检验上述反应中Fe2(SO4)3是否消耗完的实验方案:___________________________。
(6)该方法的优点之一是Fe2(SO4)3易再生。向反应后的溶液中通入___________,就能达到使Fe2(SO4)3再生的目的,方便且价廉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选)下列有关氯水的叙述,正确的是( )
A. 新制氯水只含有氯分子和次氯酸分子
B. 新制氯水可使紫色石蕊溶液先变红后褪色
C. 氯水光照时有气泡逸出,该气体的主要成分是氯气
D. 氯水放置数天后,其酸性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) + 2 H2(g) ![]() CH3OH(g)
CH3OH(g)
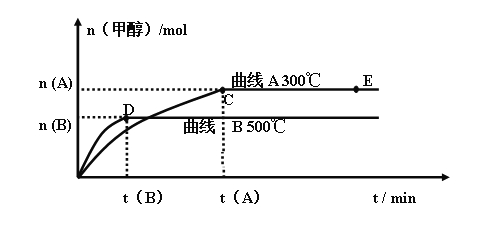
不同温度时甲醇的物质的量随时间变化曲线如上图所示。根据题意完成下列各题:
(1)反应达到平衡时,升高温度,化学平衡常数K值____________(填“增大”、“减小”或“不变”)。
(2)在其他条件不变的情况下,将E点的体系体积压缩到原来的 ,下列有关该体系的说法正确的是___________
a 氢气的浓度减小 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大 e 平衡常数K增大
Ⅱ、在1 L的密闭容器中,进行反应到:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
T(℃) | 700 | 800 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.7 | 2.6 |
(1) 将0.1 mol CO与0.1 mol H2O混合加热到800℃,一段时间后该反应达到平衡,测得CO2的物质的量为0.053 mol,若将混合气体加热至830℃,平衡时CO2的物质的量_____ (填“大于”、等于“”或“小于”)0.053 mol。
(2)800℃时,放入CO、H2O、CO2、H2,其物质的量分别为:0.01、0.01、0.01、0.01mol。则反应CO2(g)+H2(g) ![]() CO(g)+H2O(g)向_________ (填“正反应”或“逆反应”)方向进行。
CO(g)+H2O(g)向_________ (填“正反应”或“逆反应”)方向进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去乙酸乙酯中残留的乙酸,有效的处理方法是( )
A. 蒸馏 B. 水洗后分液
C. 用过量饱和碳酸钠溶液洗涤后分液 D. 用过量氯化钠溶液洗涤后分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com