
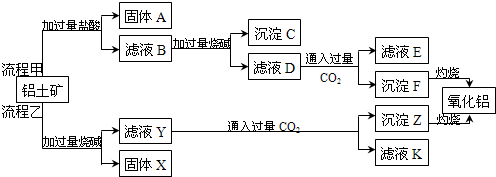
分析 由工艺流程甲可知,铝土矿与盐酸反应得固体A为滤液B,则固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠、NaOH,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3;
根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO等,滤液Y为硅酸钠、偏铝酸钠,滤液中通入过量二氧化碳,沉淀Z为Al(OH)3、硅酸,滤液K中含有NaHCO3,以此来解答.
解答 解:由工艺流程甲可知,铝土矿与盐酸反应得固体A为滤液B,则固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠NaOH,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3;
根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO等,滤液Y为硅酸钠、偏铝酸钠,滤液中通入过量二氧化碳,沉淀Z为Al(OH)3、硅酸,滤液K中含有NaHCO3,
(1)Al2O3与盐酸反应生成氯化铝和水,氧化物不能拆,离子方程式为:Al2O3+6H+═2Al3++3H2O,故答案为:Al2O3+6H+═2Al3++3H2O;
(2)二氧化硅与氢氧化钠反应生成硅酸钠和水,二氧化硅不能拆,故离子反应方程式为:SiO2+2OH-═SiO32-+H2O,故答案为:SiO2+2OH-═SiO32-+H2O;
(3)Fe3+与硫氰化钾溶液反应,使溶液变红色,检验滤液B中是否含Fe3+离子的方法为:取少量滤液B,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+,
故答案为:硫氰化钾;
(4)根据工艺流程甲可知,固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠,所以向滤液D中通入过量二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠,则滤液E中溶质为NaHCO3,碳酸氢钠可用于制纯碱或做发酵粉等,
故答案为:NaHCO3;制纯碱或做发酵粉等.
点评 本题以氧化铝提取工艺流程为载体考查混合物分离实验方案的设计,为高频考点,涉及无机物推断、元素化合物性质及相互转化、除杂的方法、离子方程式等,侧重分析与实验能力的考查,题目难度中等.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
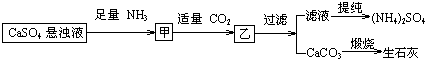
| A. | 通入CO2和NH3顺序可以颠倒 | |
| B. | 通入的NH3必须过量 | |
| C. | CO2可被循环使用 | |
| D. | 生成1mol(NH4)2SO4至少消耗2 mol NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
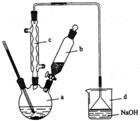 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 对叔丁基苯酚
对叔丁基苯酚 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下: .该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com