
(15分)
M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素。M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子。请回答下列问题:
(1)元素Q的名称为__________,P的基态原子价层电子排布式为__________ 。
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低,是因为__________________________.
(3)M、O电负性大小顺序是__________(用元素符号表示),O的最高价含氧酸根的空间构型为__________,其中心原子的杂化类型为___________。
(4)M、N形成的化合物的晶胞如图所示,该晶胞的化学式为__________ ,其中M离子的配位数为__________,该晶体类型为___________。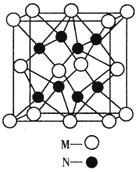
(5)该晶胞的边长为a×10 cm,则距离最近的M、N离子间的距离为
cm,则距离最近的M、N离子间的距离为
__________cm。
(1)锰(1分) 3d54s1(2分)
(2)HF分子间存在氢键,而HCl分子间无氢键(2分)
(3)O>Cl(1分) 正四面体形(1分) sp3杂化(1分)
(4)Na2O(2分) 8(1分) 离子晶体(1分)
(5)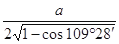 ×10-10或
×10-10或 ×10-10或
×10-10或 ×10-10(3分,或其他合理答案)
×10-10(3分,或其他合理答案)
解析试题分析:依题意可知:M为氧元素,N为钠元素,O是氯元素,P是铬元素,Q是锰元素,因此有:
(1)元素Q的名称为锰,P的基态原子价层电子排布式为3d54s1;
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低是因为HF分子间存在氢键,而HCl分子间无氢键
(3)M、O电负性大小顺序是O>Cl,O的最高价含氧酸根为ClO4-,空间构型为正四面体。空间构型其中心原子的杂化类型为sp3杂化
(4)M微粒的数目为: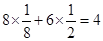 ;N微粒的数目为:8;因此M、N形成的化合物的晶胞的化学式为Na2O;其中M离子的配位数为8,该晶体类型为离子晶体。
;N微粒的数目为:8;因此M、N形成的化合物的晶胞的化学式为Na2O;其中M离子的配位数为8,该晶体类型为离子晶体。
(5)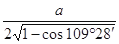 ×10-10或
×10-10或 ×10-10或
×10-10或 ×10-10
×10-10
考点:考查物质结构。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:填空题
(10分)下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用相应化学用语回答下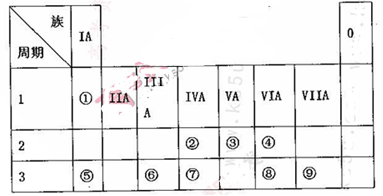
列问题:
(1)画出表中形成化合物种类最多元素的原子结构示意图____;写出它与原予半径最小的原子形成10电子且为正四面体结构的化合物的电子式____,用电子式表示⑤和⑧形成化合物的过程________。
(2).④⑤⑧形成的简单离子半径由大到小的顺序为____(填离子符号);③⑦⑨的最高价氧化物对应水化物的酸性由强到弱的顺序为_______(填化学式)。
(3).⑤和⑨形成化合物的化学键为__________。
(4).这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱反应的是_______(填化学式),写出它与⑤的最高价氧化物对应水化物发生反应的离子方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分) A、B、C、D、E均为短周期元素,且原子序数依次增大。已知B元素在自然界中组成化合物的种类最多;D原子最外层电子数与核外电子数之比为3:4;A与D、E与D均可组成原子个数比为1:1和2:1的两种化合物。据此回答:
(1)由A、C、D三种元素可组成多种化合物,写出其中两种常见化合物的化学式 。
(2)在C和B组成化合物 (CB)2中,C、B原子均满足最外层8电子结构,,则(CB)2的电子式是 。
(3)化合物E3C与水反应的原理和氮化镁与水反应的原理相同,写出E3C与盐酸反应的化学方程式 。
(4)已知B与A可组成化合物甲,D与A可组成化合物乙,每个甲、乙分子中均含有18个电子
① 甲在过量的D单质中充分燃烧,燃烧热是1559 kJ / mol,写出该反应的热化学方程式 。
② 在酸性条件下,向FeI2的淀粉溶液中加入乙,溶液变蓝。当1mol Fe2+被氧化成Fe3+时,反应中电子转移为4 mol,写出该反应的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(本题共12分)
沸石是一大类天然结晶硅铝酸盐的统称。自然界中已发现的沸石有30多种,较常见的有方沸石NaAlSi2O6·H2O、钠沸石Na2Al2Si3O10·2H2O和钙沸石CaAl2Si3O10·3H2O等。
完成下列填空:
23.钠原子核外共有 种不同能量的电子,这些电子分占 种不同的轨道。
24.常温下,下列5种钠盐浓度均为0.1mol·L-1的溶液,对应的pH如下:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语
回答下列问题:
(1)④、⑤、⑦的原子半径由大到小的顺序为_______(用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为_______>_______。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe+氧化,写出该反应的离子方程式_______。
(4)由表中元素形成的物质可发生如图中的反应,
其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
①写出D溶液与G反应的化学方程式______________.
②写出检验A溶液中溶质的阴离子的方法:______________.
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为_______mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)下图是元素周期表的一部分,其中每个数字编号代表对应的一种元素。
| ① | | | ||||||
| | | | | ② | ③ | ④ | | |
| ⑤ | | ⑥ | ⑦ | | | ⑧ | ⑨ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,Q、W、Z是非金属元素。五种元素核电荷数之和为55,对应原子最外层电子数之和为21。W、Z最外层电子数相同,但Z的核电荷数是W的2倍。
(1)Q在周期表中位于第 周期 族。
(2)X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,请写出该反应的离子方程式: 。
(3)X单质能在W单质中燃烧可生成化合物R,R的电子式 ___,该物质所含有的化学键的类型为 。
(4)Z的氢化物与W的氢化物发生反应生成Z单质和水,写出其化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);D原子的基态电子排布式为___________________________________。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC的空间构型为________(用文字描述)。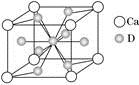 (3)1 mol AB-中含有的π键个数为________。
(3)1 mol AB-中含有的π键个数为________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是________。
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
 W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2
W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2 17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。
17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com