


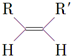
 $\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO
$\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO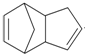 $\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$
$\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$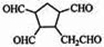 .
. 分析 (1)由碳碳双键为平面结构分析环戊二烯分子中最多共平面的原子数;
(2)金刚烷的分子中有6个CH2,4个CH结构,据此判断其分子式;
(3)由合成路线可知,反应①为光照条件下的取代反应,反应②为消去反应,反应③为加成反应,反应④为消去反应,以此来解答;
(4)根据信息可知,碳碳双键的碳上含H原子被氧化为醛,据此判断反应产物的结构简式.
解答 解:(1)C=C为平面结构,与双键碳直接相连的原子一定在同一平面内,则5个C和4个H在同一平面内,故答案为:9;
(2)由C原子形成4个共价键,由结构简式可知金刚烷的分子中有6个CH2,4个CH结构,分子式为C10H16,故答案为:C10H16;6;
(3)由合成路线可知,反应①为光照条件下的取代反应,其产物名称为氯代环戊烷;反应②卤素原子的消去反应,反应条件为氢氧化钠的醇溶液;反应③为加成反应,反应方程式为: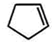 +Br2→
+Br2→ ,反应④为卤代烃的消去反应,
,反应④为卤代烃的消去反应,
故答案为:氯代环戊烷;加成反应;
(4)由信息可知,碳碳双键的碳上含H原子被氧化为醛,则发生反应: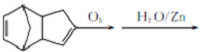
 ,
,
故答案为: .
.
点评 本题考查有机物的合成,题目难度中等,注意把握有机物的官能团、碳链骨架等的变化,明确发生的反应及习题中的信息即可解答,试题培养了学生灵活应用基础知识的能力.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
 将一定量Mg、Al合金溶于1mol•L-1的HCl溶液中,进而向所得溶液中滴加1mol•L-1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示.下列分析的结论中正确的是( )
将一定量Mg、Al合金溶于1mol•L-1的HCl溶液中,进而向所得溶液中滴加1mol•L-1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示.下列分析的结论中正确的是( )| A. | 无法给出实验中产生H2的物质的量 | |
| B. | 欲给出a的取值范围尚缺少一个条件 | |
| C. | 无法认定Mg、Al合金中$\frac{n(Mg)}{n(Al)}$的最大值 | |
| D. | 溶解“一定量Mg、Al合金”的HCl溶液的体积为90mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯化铝溶液中加入过量的氨水Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 铝片投入硝酸汞溶液中:Al+Hg2+═Al3++Hg | |
| D. | 金属钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 验方法 | 沉淀法 | 显色法 | 气体法 |
| 判断的依据 | 反应中有沉淀产生或溶解 | 反应中有颜色变化 | 反应中有气体产生 |
| A. | CO32---气体法 | B. | SO42---沉淀法 | C. | H+--显色法 | D. | Cl---气体法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4L | |
| B. | 1mol臭氧和1.5mol氧气含有相同的氧原子数 | |
| C. | 等体积、浓度均为1mol•L-1的磷酸和盐酸,电离出的氢离子数之比为3:1 | |
| D. | 等物质的量的干冰和葡萄糖中所含碳原子数之比为1:6,氧原子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z为0.3 mol/L | B. | Y2为0.1 mol/L | C. | X2为0.2 mol/L | D. | Z为0.35mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
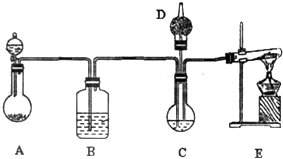 纳米碳酸钙有广泛的应用前景.用下图所示装置,在浓CaCl2溶液中通入NH3和CO2可制得纳米级碳酸钙.D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.
纳米碳酸钙有广泛的应用前景.用下图所示装置,在浓CaCl2溶液中通入NH3和CO2可制得纳米级碳酸钙.D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com