
【题目】化合物I(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基,I可以用E和H在一定条件下合成:
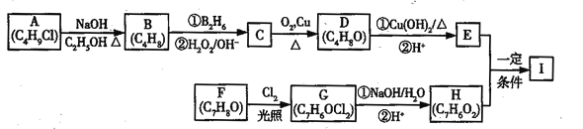
已知以下信息:
①A的核磁共振氢谱表明其只有一种化学环境的氢;
②R﹣CH=CH2![]() R﹣CH2CH2OH;
R﹣CH2CH2OH;
③化合物F苯环上的一氯代物只有两种;
④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
回答下列问题:
(1)A的化学名称为_______________________________;
(2)D的结构简式为_______________________________;
(3)E中的官能团名称为___________________________;
(4)F生成G的化学方程式为__________________________,该反应类型为______________;
(5)I的结构简式为_________________________________。
(6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件:①苯环上只有两个取代基,②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,共有____种(不考虑立体异构)。J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式________________________________。
【答案】2﹣甲基﹣2﹣氯丙烷 (CH3)2CHCHO 羧基 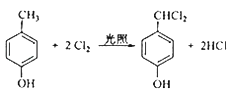 取代反应
取代反应 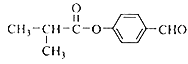 18
18 ![]()
【解析】
A的分子式为C4H9Cl,核磁共振氢谱表明其只有一种化学环境的氢,则A为(CH3)3CCl,在氢氧化钠醇溶液、加热条件下发生消去反应,生成B为CH2=C(CH3)2,根据信息2, B发生反应生成C则C为(CH3)2CHCH2OH,C发生催化氧化生成D,D为(CH3)2CHCHO,D再与氢氧化铜反应,酸化得到E,E为(CH3)2CHCOOH,F的分子式为C7H8O,苯环上的一氯代物只有两种,应含有2个不同的侧链,且处于对位,则F为![]() ,与氯气在光照条件下发生取代反应,生成G为
,与氯气在光照条件下发生取代反应,生成G为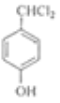 ,G在氢氧化钠水溶液中发生水解反应,酸化得到H,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故H为
,G在氢氧化钠水溶液中发生水解反应,酸化得到H,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故H为![]() ,H与E发生酯化反应生成I,其分子中含有醛基和酯基,故I为
,H与E发生酯化反应生成I,其分子中含有醛基和酯基,故I为![]() 。
。
A的分子式为C4H9Cl,核磁共振氢谱表明其只有一种化学环境的氢,则A为(CH3)3CCl,在氢氧化钠醇溶液、加热条件下发生消去反应,生成B为CH2=C(CH3)2,根据信息2, B发生反应生成C则C为(CH3)2CHCH2OH,C发生催化氧化生成D,D为(CH3)2CHCHO,D再与氢氧化铜反应,酸化得到E,E为(CH3)2CHCOOH,F的分子式为C7H8O,苯环上的一氯代物只有两种,应含有2个不同的侧链,且处于对位,则F为![]() ,与氯气在光照条件下发生取代反应,生成G为
,与氯气在光照条件下发生取代反应,生成G为 ,G在氢氧化钠水溶液中发生水解反应,酸化得到H,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故H为
,G在氢氧化钠水溶液中发生水解反应,酸化得到H,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故H为![]() ,H与E发生酯化反应生成I,其分子中含有醛基和酯基,故I为
,H与E发生酯化反应生成I,其分子中含有醛基和酯基,故I为![]() 。
。
(1)由上述分析可知,A为(CH3)3CCl,化学名称为2-甲基-2-氯丙烷;
(2)由上述分析可知,D的结构简式为(CH3)2CHCHO;
(3) E为(CH3)2CHCOOH,E中的官能团为羧基;
(4) F与氯气发生取代反应生成G,化学方程式为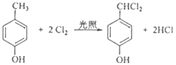 ;
;
(5)由上述分析可知,I的结构简式为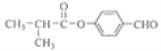 ;
;
(6)I( )的同系物J比I相对分子质量小14,说明J比I少一个CH2原子团,J的同分异构体中能同时满足如下条件:①苯环上只有两个取代基,②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,则J的同分异构体中含有醛基和羧基,侧链可能为:-CHO和-CH2CH2COOH、-CHO和-CH(CH3)COOH、-CH2CHO和-CH2COOH、-CH2CH2CHO和-COOH、-CH(CH3)CHO和-COOH、-CH3和-CH(CHO)COOH,各有邻、间、对三种位置,则符合条件的同分异构体有6×3=18种,J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,而J的同分异构体发生银镜反应并酸化后的产物苯环侧链至少有2种H原子,则产物中苯环上只有1种H原子,产物有2个-COOH,应还含有2个-CH2-,2个侧链相同且处于对位,产物中侧链为-CH2COOH,则符合条件的同分异构体结构简式为:
)的同系物J比I相对分子质量小14,说明J比I少一个CH2原子团,J的同分异构体中能同时满足如下条件:①苯环上只有两个取代基,②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,则J的同分异构体中含有醛基和羧基,侧链可能为:-CHO和-CH2CH2COOH、-CHO和-CH(CH3)COOH、-CH2CHO和-CH2COOH、-CH2CH2CHO和-COOH、-CH(CH3)CHO和-COOH、-CH3和-CH(CHO)COOH,各有邻、间、对三种位置,则符合条件的同分异构体有6×3=18种,J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,而J的同分异构体发生银镜反应并酸化后的产物苯环侧链至少有2种H原子,则产物中苯环上只有1种H原子,产物有2个-COOH,应还含有2个-CH2-,2个侧链相同且处于对位,产物中侧链为-CH2COOH,则符合条件的同分异构体结构简式为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】化学反应原理对化学反应的研究具有指导意义。
(1)机动车废气排放已成为城市大气污染的重要来源。气缸中生成NO的反应为:N2(g)+O2(g) ![]() 2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点可能的原因___________、_____________。
2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点可能的原因___________、_____________。
(2)由金红石TiO2制取单质Ti,涉及到的步骤为:
TiO2![]() TiCl4
TiCl4![]() Ti
Ti
已知:①Cs+O2g=CO2g; H=3935 kJ·mol1
②2COg+O2g=2CO2g; H=566 kJ·mol1
③TiO2s+2Cl2g=TiCl4s+O2g; H=+141 kJ·mol1
则TiO2s+2Cl2g+2Cs=TiCl4s+2COg的H=________________。
(3)氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有1/3与水反应。该反应的化学方程式为______,在上述平衡体系中加入少量NaOH固体,溶液中Cl—浓度_______(选填“增大”、“减小”或“不变”)。
(4)一定条件下,Fe3+和I—在水溶液中的反应是2I—+2Fe3+![]() I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向_______(选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案_____。
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向_______(选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案_____。
(5)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅰⅰ.![]()
![]()
①写出此条件下,反应A的热化学方程式___________。
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为__________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是( )
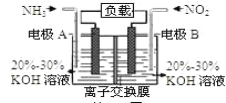
A.电流从右侧电极经过负载后流向左侧电极
B.A电极上发生氧化反应,B为正极
C.当有2.24LNO2(标准状况)被处理时,转移电子为0.4mol
D.电极A极反应式为2NH3-6e-=N2+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯二氧化硅可用来制造光纤。某蛇纹石的成分见下表:
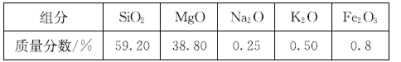
通过下图流程可由蛇纹石制备较纯净的二氧化硅。
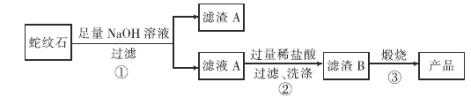
(1)蛇纹石中涉及的可溶性金属氧化物有 _______________________________ (写化学式)。
(2)步骤①中涉及SiO2反应的离子方程式为 _____________________________ 。
(3)滤渣A的成分有________________(填化学式)。
(4)步骤②中洗涤沉淀的方法是_________________________________________________ 。
(5)实验室进行步骤③需要用到的仪器有坩埚、泥三角、酒精灯、玻璃棒、_____________和_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4=HBr+NaHSO4①
R—OH+HBr![]() R—Br+H2O②
R—Br+H2O②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据见下表:
乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
密度/g.cm3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1溴丁烷的制备实验中,下列仪器最不可能用到的是________(填字母)。
a.圆底烧瓶 b.量筒 c.锥形瓶 d.布氏漏斗
(2)溴代烃的水溶性________(填“大于”、“等于”或“小于”)相应的醇,其原因是______________________________________________________________。
(3)将1溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在________(填“上层”“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的是________(填字母)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)欲除去溴乙烷中的少量杂质Br2,下列物质中最适合的是________(填字母)。
a.NaI b.NaOH c.NaHSO3 d.KCl
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于___________________,但在制备1溴丁烷时却不能边反应边蒸出产物,其原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系中的物质有HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反应物之一;As是生成物之一。
(1)①写出未配平的该反应的化学方程式:_________________________
②在该反应中,得电子的物质是__________,被氧化的元素是____________。
③在反应中,每转移1 mol电子,消耗HCl________mol。
④下列叙述中不正确的是_____________________(填写字母序号)。
a.在相同条件下,第ⅦA族元素的阴离子的还原性从上到下逐渐增强
b.得电子越多的氧化剂,其氧化性越强
c.阳离子只能作氧化剂
d.在相同条件下,氧化性顺序:Fe3+>Cu2+>H+>Fe2+
(2)①向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。该反应的离子方程式为_________________________,如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。该反应的化学方程式为____________________。
②把KI换成KBr,则CCl4层变为_______________色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积可变的密闭容器中加入WO3和H2进行反应:WO3(s)+3H2(g)![]() W(s)+3H2O(g),下列说法不正确的是( )
W(s)+3H2O(g),下列说法不正确的是( )
A.将容器的体积缩小一半,其反应速率增大
B.保持体积不变,充入氩气,其反应速率不变
C.保持压强不变,充入氖气,H2O(g)的生成速率增大
D.保持压强不变,充入氖气,H2O(g)、H2(g)的生成速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
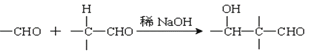
【题目】以乙炔为原料通过以下流程能合成有机物中间体D。

已知:(1)
(2):
请回答下列问题:
(1)化合物A的分子式为___________,1mol A完全燃烧需要消耗_____mol氧气。
(2)反应②的反应类型是:______________;化合物B的名称是:____________。
(3)写出①反应的化学方程式_________________________________________________。
(4)已知1mol HCHO和1mol CH3CH2CHO发生类似已知(2)的反应,生成1molE。写出E的结构简式为:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是现代社会发展的三大支柱之一,化学在提高能源的利用率和开发新能源中起到了重要的作用。电能是现代社会中应用最广泛的二次能源。
(1)下列装置中能够实现化学能转化为电能的是______(填字母)。
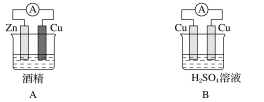

(2)写出该装置正极反应的电极反应式_________。
(3)该装置中溶液里的阴离子移向______________(填电极的化学式)极。
(4)若装置中转移了0.2mol电子,则理论上溶液增加的质量是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com