
(共16分)选酚酞作指示剂,用中和滴定法测定烧碱样品的纯度(所含杂质不与盐酸反应)。
试根据实验回答:
(1)准确称取4.8g烧碱样品,所用仪器除了药匙,烧杯外,还需有 、 。
(2)将已称好的样品配成250 mL待测液,需要的仪器除了烧杯,玻璃棒还有 、 。
(3)用0.2000 mol / L标准盐酸滴定待测烧碱溶液,滴定时边滴边摇动锥形瓶,两眼注视 ,直到滴定终点。
(4)判断到达滴定终点的实验现象是 。
(5)根据下列数据计算,待测烧碱溶液的浓度为 。(计算结果保留四位有效数字)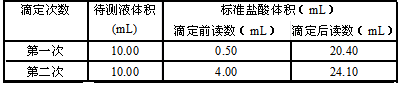
(6)根据上述数据计算,烧碱样品的纯度为
(7) ①如烧碱中杂质能与盐酸反应(如Na2CO3),,则烧碱样品纯度 (填“偏高”, “偏低”或“无影响”)
②如果把指示剂由酚酞换成甲基橙,则烧碱样品纯度 (填“偏高”, “偏低”或“无影响”)
(共16分)(1) 托盘天平、砝码 (2) 容量瓶、胶头滴管
(3) 锥形瓶内颜色变化 (4) 颜色由红色变为浅红色,且半分钟内颜色不变
(5) 0.4000mol\L (6) 83.33% (7) 偏低 无影响
解析试题分析:配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以(1)准确称取4.8g烧碱样品,所用仪器除了药匙,烧杯外,还需有托盘天平、砝码,(2)将已称好的样品配成250 mL待测液,需要的仪器除了烧杯,玻璃棒还有容量瓶、胶头滴管;(3)滴定时,两眼注视锥形瓶中溶液颜色的变化,以便准确判断终点的到达;答案为:锥形瓶中溶液颜色的变化;(4)判断到达滴定终点的实验现象是:颜色由红色变为浅红色,且半分钟内颜色不变;(5)V(标准)═[(20.40-0.50)+(24.10-4.00)]mL÷2═20.00mL, C(待测)═c(标准)V(标准)/ V(待测)= 0.2000mol/L×20Ml/10mL (6)则m =" CVM" = 0.4000mol?L-1×0.25L×40g/mol═4.0g ,ω(NaOH)═4.0/4.8×100%═83.33%,答案为:83.33%;(7)根据C(待测)═c(标准)V(标准)/ V(待测),如烧碱中杂质能与盐酸反应(如Na2CO3),因为称量质量一定Na0H 80克消耗2molHCl Na2CO3 106克消耗2molHCl,NaOH的浓度降低,标准酸液消耗体积减少,偏低,如果把指示剂由酚酞换成甲基橙,因为是强酸强碱盐,则烧碱样品纯度无影响。
考点:考查配制一定物质的量浓度的溶液,


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
10分)利用下图装置测定中和热的实验步骤如下: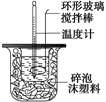
①用量筒量取50 mL 0.25 mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ·mol-1):____________________________________________________________________。
(2)倒入NaOH溶液的正确操作是__________(从下列选项中选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是________(从下列选项中选出)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白: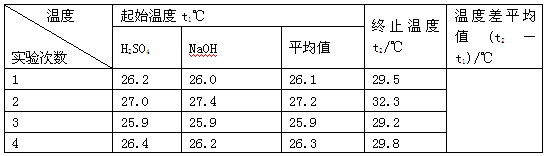
②近似认为0.55 mol·L-1NaOH溶液和0.25 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶的比热容c=4.18 J·g-1·℃-1。依据上表数据计算中和热ΔH=________(取小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列在水溶液中电离方程式书写正确的是
A.HClO H++Cl -+ O 2- H++Cl -+ O 2- |
B.H2CO3 2H++ CO32- 2H++ CO32- |
| C.NaHSO4=Na++HSO4– |
D.NH3·H2O NH4++OH- NH4++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净并检查不漏水,且用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00 mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净并检查不漏水后,立即向其中注入0.1000 mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且在30 s内颜色不再变化,测得所耗盐酸的体积为V1 mL。
④重复以上过程,但在滴定过程中向锥形瓶中加入5 mL的蒸馏水,测得所耗盐酸的体积为V2 mL。
试回答下列问题:
(1)锥形瓶中的溶液从_____色变为_____色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察_____。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是__________。由此造成的测定结果_____(填“偏高”、“偏低”或“无影响”)
(4)步骤②缺少的操作是__________。
(5)如图,是某次滴定时的滴定管中的液面,其读数为_____ mL。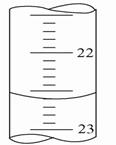
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
11分)(1)下图分别是温度计、量筒、滴定管的一部分,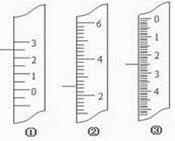
则:量筒应该是 读数为 mL,滴定管应该是 读数为 mL,温度计应该是 。
(2)实验室有一瓶混有氯化钠的氢氧化钠固体试剂,为了验证其纯度,用已知浓度的盐酸进行滴定,试回答下列问题:
①称取一定质量固体试剂配制100mL溶液。
②将标准盐酸装在25.00mL 滴定管中,调节液面位置在 ,并记下刻度。
③取20.00mL待测液,待测定。该项实验操作的主要仪器有 。
用 试剂作指示剂。
④下列实验操作会引起氢氧化钠含量偏高的是 。
| A.滴定前滴定管尖嘴有气泡,滴定后滴定管尖嘴无气泡 |
| B.中和滴定时,锥形瓶内有少量蒸馏水 |
| C.酸式滴定管用蒸馏水洗后,用标准液润洗2-3次 |
| D.读取滴定管终点读数时,仰视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在西部大开发中,将投巨资兴建“西气东输”工程,将西部蕴藏的丰富资源通过管道输送到东部地区。这里所指的“西气”的主要成分是
| A.CH4 | B.CO | C.H2 | D.NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
2013年7月23日,央视记者分别在北京崇文门附近的麦当劳、肯德基以及真功夫3家大型快餐店取回可食用冰块进行抽样检测。检测结果显示:3家快餐店食用冰块菌落总数严重超标。下列说法正确的是
| A.肉毒杆菌有毒,可在其中加入硫酸铜使其变性后食用 |
| B.肉毒杆菌在体内水解生成的氨基酸不能成为人体重要的营养物质 |
| C.大肠杆菌分子中不一定含羧基和氨基 |
| D.出血性大肠杆菌和油脂均为能水解的高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com