
【题目】在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 CO2和0.2molCO2,在不同温度下反应CO2(g)+c(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是

A.反应CO2(g)+c(s)![]() 2CO(g) △S>0、△H<0
2CO(g) △S>0、△H<0
B.体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)>2c(CO,状态Ⅲ)
D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ)
【答案】B
【解析】
试题分析:A、C和CO2反应是吸热反应,△H>0,A错误;B、Ⅰ这条曲线,是通入0.1molCO2,Ⅱ这条曲线是通入0.2molCO2,状态Ⅱ可以看作先通0.1CO2,此时的压强相等,再通入0.1molCO2,假设平衡不移动,此时的压强等于2倍P总(状态Ⅰ),但要求CO2的浓度相等,应对此加热使反应向正反应方向移动,气体物质的量增加,因此P总(状态Ⅱ)>2P总(状态Ⅰ),B正确;C、状态Ⅱ可以看作先通0.1molCO2,此时两者CO的浓度相等,在通入0.1molCO2,假设平衡不移动,Ⅱ状态CO的浓度等于2倍Ⅲ,但再充入CO2,相当增大压强,平衡右移,消耗CO,因此c(CO,状态Ⅱ)<2c(CO,状态Ⅲ),C错误;D、温度越高,反应速率越快,V逆(状态Ⅰ)<V逆(状态Ⅲ),D错误。答案选B。


科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合图的是

A.CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O ΔH<0
CO(NH2)2(s)+H2O ΔH<0
B.CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
C.CH3CH2OH(g)![]() CH2=CH2(g)+H2O(g) ΔH>0
CH2=CH2(g)+H2O(g) ΔH>0
D.2C6H5CH2CH3(g)+O2(g)![]() 2C6H5CH=CH2(g)+2H2O(g) ΔH<0
2C6H5CH=CH2(g)+2H2O(g) ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达不正确的是( )
A. 体积②>③>①>④ B. 密度②>③>④>①
C. 质量②>③>①>④ D. 氢原子个数①>④>③>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色) ![]() 2CrO42-(黄色)+2H+ 。用K2Cr2O7溶液进行下列实验,结合实验,下列说法不正确的是( )
2CrO42-(黄色)+2H+ 。用K2Cr2O7溶液进行下列实验,结合实验,下列说法不正确的是( )

A. ①中溶液橙色加深,③中溶液变黄 B. ②中Cr2O72-被C2H5OH还原
C. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色 D. 对比②和④可知K2Cr2O7酸性溶液氧化性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用光洁铂丝蘸取某无色溶液,在无色火焰上灼烧,火焰呈黄色,则无色溶液中( )
A.只有Na+
B.一定有Na+ , 可能有K+
C.一定有Na+和K+
D.可能有Na+和K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1913年,丹麦科学家玻尔第一次认识到氢原子光谱是氢原子的电子跃迁产生的。玻尔的原子结构理论一个很大的成就是( )。
A. 证明了原子核外电子在圆形轨道上运动
B. 提出了原子核是可以进一步细分的
C. 解决了氢原子光谱和原子能级之间的关系
D. 应用了量子力学理论中的概念和方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)俗称“工业盐”,其外观与食盐相似,有咸味,有毒,可用做食品防腐剂和肉类食品的发色剂。已知亚硝酸钠能与氢碘酸(HI,具有强酸性)发生如下反应:4HI+2NaNO2=2NaI+I2+2NO↑+2H2O。下列说法正确的是
A. 亚硝酸钠具有氧化性,不可能表现出还原性
B. 该反应中氧化剂与还原剂的物质的量之比为1:1
C. 向反应所得的混合溶液中加入稀硫酸和亚硝酸钠,I-不可能转化为I2
D. 人误食亚硝酸钠中毒时,可服用氢碘酸解毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入一定量SO2、O2发生反应2SO2(g)+O2(g)![]() 2SO3(g), 测得SO3浓度与反应温度关系如图.下列说法正确的是
2SO3(g), 测得SO3浓度与反应温度关系如图.下列说法正确的是
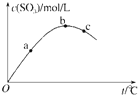
A.该反应△H>0
B.SO2转化率:a>b>c
C.化学反应速率:c>b>a
D.平衡常数K:b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、T是原子序数依次増大的五种短周期元素,且X、Y、Z、W的原子序数之和为32。其中X是元素周期表中原子半径最小的元素,Y、Z左右相邻,Z、W位于同一主族。T的单质常用于自来水的杀菌消毒。
请回答下列问题:
(1)W元素在周期表中的位置为:____________________
(2)由 X、Y、Z、W四种元素中的三种组成一种强酸,该强酸的稀溶液能与金属铜反应,该反应的离子方程式为____________________。
(3)Y元素的气态氢化物与其最高价氧化物的水化物可以相互反应,写出其离子方程式:______________
(4)Y和T两元素的非金属性强弱为Y________T (填“>”“<”或者“=”)。可以验证该结论的方法是___________________
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素所形成含氧酸的酸性
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素与氢气化合的难易程度
E.比较这两种元素气态氢化物的还原性
(5)某化学兴趣小组欲通过实验探究元素N、C、Si 非金属性强弱。实验装置如下:
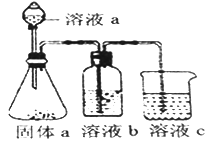
①溶液a和溶液b分别为__________溶液、________溶液(填溶质化学式)
②经验证,N、C、Si的非金属性由强到弱为:__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com