
����Ŀ����ҺM�к���MgCl2��KCl��AlCl3��ijС������ͼ��ʾ���̶�����д����Ի�ýϴ�����AlCl3��Һ����֪:AlO2-+CO2+2H2O=Al(OH)3��+HCO3-,��ش�:
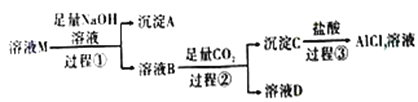
��1������A�Ļ�ѧʽΪ_______����������Al3+������Ӧ�����ӷ���ʽΪ_______��
��2�����������е�����������Һ_____(������������������)�ð�ˮ���棬ԭ����_______��
��3����ҺB�д������ڵ���������______����������Ӧ�����ӷ���ʽΪ_______��
���𰸡� Mg(OH)2 Al3++4OH-=AlO2-+2H2O ���� Al3+�백ˮ��Ӧ����Al(OH)3��,Al(OH)3�����백ˮ������Ӧ,�Ӷ����ܽ�Al(OH)3��Mg(OH)2�ֿ� K+��Na+ Al(OH)3+3H+=Al3++3H2O
����������ҺM������������������Һ��Ӧ����AΪMg(OH)2���õ�����ҺB�к���NaAlO2��KCl��NaCl��������NaOH����ҺB�������Ķ�����̼��Ӧ�õ�����CΪAl(OH)3����ҺD�к���KCl��NaCl��NaHCO3������C�����ᷴӦ����AlCl3��ˮ������1������A�Ļ�ѧʽΪMg(OH)2����������Al3+�����������������з�����Ӧ����ƫ�����ƣ���Ӧ�����ӷ���ʽΪAl3++4OH-=AlO2-+2H2O����2�����������е�����������Һ�����ð�ˮ���棬ԭ����Al3+�백ˮ��Ӧ����Al(OH)3��,Al(OH)3�����백ˮ������Ӧ,�Ӷ����ܽ�Al(OH)3��Mg(OH)2�ֿ�����3����ҺB�к���NaAlO2��KCl��NaCl��������NaOH���ʺ��д������ڵ���������K+��Na+�����������������������ᣬ��Ӧ�����ӷ���ʽΪAl(OH)3+3H+=Al3++3H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��D��E��W����ѧ����������Ԫ�أ�ԭ��������������A��ԭ�������������Ǵ�����2����D���������������������D��Eλ��ͬ���ڣ�A��D��E��ԭ������������֮��Ϊ14��W������������Ԫ�أ�ȱ��W�ᵼ��ƶѪ֢״��
��1��A��Ԫ�����ڱ��е�λ������
��2��������ʵ����Ԫ�������ɽ��͵���(����ĸ��ţ���
a . D������������Ӧˮ����ļ�������Mg(OH)2
b. E����̬�⻯����ȶ���С��HF
c. WE3����Һ�����ڿ�ʴͭ�Ƶ�ӡˢ��·��
��3��E�ĵ��ʿ��Դ�NaBr��Һ���û���Br2���ʣ���ԭ�ӽṹ�ĽǶȽ�����ԭ������
��4���ٹ�ҵ���õ�ⷨ�Ʊ�D�ĵ��ʣ���Ӧ�Ļ�ѧ����ʽΪ��
�ڼ��á��ܵ�ͨ������Ч�ɷ����ռ��D�ĵ��ʣ�ʹ��ʱ�����һ������ˮ����ʱ������Ӧ�Ļ�ѧ����ʽΪ��
��5��W�ĵ��ʿ����ڴ������Է�ˮ�е�NO3- �� ʹ��ת��ΪNH4+ �� ͬʱ�����д��Ե�W��������X���ٽ��к���������
�� ������Ӧ�����ӷ���ʽΪ��
�� D�ĵ�����X�ڸ����·�Ӧ�Ļ�ѧ����ʽΪ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ��CuS��MnS��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵��������ǣ� �� 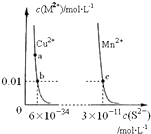
A.���¶��£�Ksp��CuS��С��Ksp��MnS��
B.��CuSO4��Һ�м���MnS�������·�Ӧ��Cu2+��aq��+MnS��s��=CuS��s��+Mn2+��aq��
C.�ں���CuS��MnS�������Һ��c��Cu2+����c��Mn2+��Ϊ2��10��23��1
D.a���Ӧ�� Ksp����b���Ӧ��Ksp
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ��c��H+ ��=5.0��10��7 mol/L�����ʱ��ˮ�е�c��OH����=�����¶Ȳ��䣬����ϡ����ʹc��H+��=5.0��10��3mol/L����c��OH����=���ڸ��¶�ʱ����ˮ�е���NaOH��Һ����Һ�е�c��OH����=5.0��10��2 mol/L������Һ��c��H+ ��= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£��ڷ�Ӧ��2SO2��g��+O2��g��2SO3��g���Ļ�ѧƽ����ϵ�У�SO2��O2��SO3��Ũ�ȷֱ�Ϊ2molL��1��0.8molL��1��2.4molL��1 �� ��O2�ڷ�Ӧ��ʼʱ���ܵ�Ũ�ȷ�Χ�ǣ� ��
A.0.8��2.0 molL��1
B.0��2.0 molL��1
C.0��0.8 molL��1
D.��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ϩ������õ��IJ��ﻥΪͬϵ����ǣ� ��
A.C2H6
B.C3H6
C.C3H8
D.C4H8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵķ�����ᴿ���������о��ж�����Ҫ��Ӧ�ã���ش�:
��1����д��ͼ���й�����������:A_______ ��B_____________��
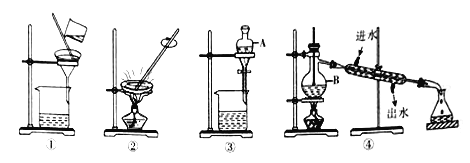
��2��װ�������Խ��ķ����ᴿ������______(���������)���������ԵĴ�����__________��
��3������������ȷ����_______(����ĸ)��
A.���뻨���ͺ�ˮӦѡװ����
B.�����ᴿʱ��ѡװ��������
C.��CCl4��ȡ��ˮ�еĵ�Ӧѡװ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������裨Si3N4����һ�������մɲ��ϣ�������ʯӢ�뽹̿�ڸ��µĵ������У�ͨ�����·�Ӧ�Ƶã� 3SiO2��s��+6C��s��+2N2��g���TSi3N4��s��+6CO��g��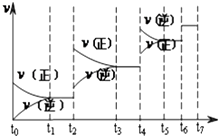
��1���÷�Ӧ��ƽ�ⳣ������ʽΪK=
��2����֪������ӦΪ���ȷ�Ӧ�����䷴Ӧ�ȡ�H0�����������������=�����������¶ȣ���ƽ�ⳣ��ֵ�����������С�����䡱���� ����֪CO��������Ϊv��CO��=18molL��1min��1 �� ��N2��������Ϊv��N2��=
��3���ﵽƽ��ı�ijһ������������ı�N2��CO����������Ӧ����v��ʱ��t�Ĺ�ϵ��ͼ��ͼ��t4ʱ����ƽ���ƶ���������������
��4��ͼ�б�ʾƽ��������CO�ĺ�����ߵ�һ��ʱ���� ��
��5����֪��2H2��g��+O2��g���T2H2O��g������H=��483.6kJmol��1��H2O��g��=H2O��l����H=��44kJmol��1 �� ���ɴ˿�֪H2ȼ���Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵķ��࣬HNO3Ӧ����
�ٻ����ڻ������������ܺ�����
A.�٢�B.�ڢ�C.�ۢ�D.�ڢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com