
【题目】在一定温度下.10mL0.40mol/LH2O2发生催化分解.不同时刻测定生成O2的休积(己折算为标准状况)如下表。
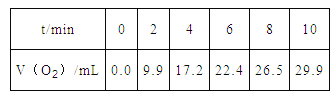
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(Lmin)
B.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(Lmin)
C.反应至6min时,c(H2O2) = 0.30mol/L
D.反应至6min时,H2O2分解了50%
【答案】C
【解析】
试题分析:2H2O2 ![]() 2H2O+O2↑,A.0~6min产生的氧气的物质的量n(O2) = 22.4mL22.4L/mol = 0.001mol,n(H2O2) = 2 n(O2) = 0.002mol,v(H2O2) = = 0.002mol÷0.01L÷6min≈3.3×10-2 mol/(Lmin),正确B.22.4÷6 = 3.73,(29.922.4)÷(106) = 1.88,3.73>1.88,故单位时间内产生的氧气,0~6min大于6~10min,故6~10min的平均反应速率:v(H2O2)<3.3×10-2 mol/(Lmin),正确;C.6min时,c(H2O2) = 0.40-(0.002÷0.01) = 0.20mol/L,错误;D.6min时,H2O2分解的分解率为:(0.20÷0.40)×100% = 50%,正确。
2H2O+O2↑,A.0~6min产生的氧气的物质的量n(O2) = 22.4mL22.4L/mol = 0.001mol,n(H2O2) = 2 n(O2) = 0.002mol,v(H2O2) = = 0.002mol÷0.01L÷6min≈3.3×10-2 mol/(Lmin),正确B.22.4÷6 = 3.73,(29.922.4)÷(106) = 1.88,3.73>1.88,故单位时间内产生的氧气,0~6min大于6~10min,故6~10min的平均反应速率:v(H2O2)<3.3×10-2 mol/(Lmin),正确;C.6min时,c(H2O2) = 0.40-(0.002÷0.01) = 0.20mol/L,错误;D.6min时,H2O2分解的分解率为:(0.20÷0.40)×100% = 50%,正确。


科目:高中化学 来源: 题型:
【题目】下列3种物质:①苯、②乙醇、③乙酸中,常用于皮肤消毒的是_______(填序号,下同);可用来萃取碘水中的碘的是_______;可与NaHCO3溶液反应产生气体的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 对于相同浓度的弱酸HX和HY(前者的Ka较小)溶液,加水稀释相同倍数时,HY溶液的pH改变值大于HX溶液的pH改变值
B. 在NH3·H2O和NH4Cl浓度均为0.1 mol·L-1的体系中,外加少量酸或碱时,溶液的pH可保持基本不变
C. 在NaH2PO4水溶液中存在关系:c(H3PO4) + c(H+) = c(HPO42-) + c(PO43-) + c(OH-)
D. 沉淀溶解平衡AgI![]() Ag++ I-的平衡常数为8.5×10-17,不能说明难溶盐AgI是弱电解质
Ag++ I-的平衡常数为8.5×10-17,不能说明难溶盐AgI是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学等多个领域潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是
3Fe2++2S2O32-+O2+xOH-![]() Fe3O4↓+S4O62-+2H2O。
Fe3O4↓+S4O62-+2H2O。
请回答下列问题:
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是_________________,S2O32-中S的化合价为________________.
(2)反应的化学方程式中![]() =_________.
=_________.
(3)每生成 1mol Fe3O4,反应转移的电子为__________mol,被Fe2+还原的O2的物质的量为__________mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知阿伏伽德罗常数可表示为NA,则下列说法正确的是
A. 任何气体单质在标准状况下体积约为22.4L,则一定含有2NA个原子
B. 常温常压下,22g氧气和26g臭氧所含氧原子总数为3NA
C. 常温常压下,22.4LH2O中含有的氢原子数为2NA
D. 标准状况下,0.3molCO2中含有氧原子数0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是 ( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是 ( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v正减小
③压强增大一倍,平衡不移动,v正、v逆不变
④增大B的浓度,v正>v逆
⑤加入催化剂,平衡向正反应方向移动
A.①② B.④ C.③ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,将amolN2与bmolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g) + 3H2(g) ![]() 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a=______________.
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量______________.
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)=_____________.
(4)达到平衡时,N2和H2的转化率之比,α(N2):α(H2)=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有广阔的海岸线,建设海峡经济区,海水的综合利用大有可为,下图所示为海水综合利用部分流程,有关说法正确的是( )
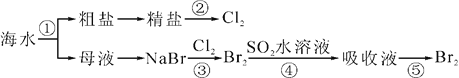
A. 上述工艺流程中涉及到化合、分解、复分解和置换反应
B. ①只发生了化学变化,②是工业上用电解熔融NaCl制备Cl2
C. ③④涉及的反应均为氧化还原反应,⑤只需要蒸馏即可得到单质Br2
D. ④中反应的离子方程式为SO2+Br2+2H2O===4H++SO42-+2Br-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com