
分析 短周期元素A、B、C、D、E位于同周期且原子序数依次增大.A、C、E三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化物之间两两皆能反应,均生成盐和水,为氢氧化铝与强碱、强酸的反应,故A为Na、C为Al,B为Mg元素,E原子最外层电子数为10-1-3=6,则E为硫元素;D原子最外层的电子数是次外层的一半,处于第三周期,最外层电子数为4,故D为Si.
(1)金属性越强,最高价氧化物对应水化物的碱性越强;
(2)主族元素周期数=电子层数、主族族序数=最外层电子数;
(3)Al与氧化铁在高温下反应生成氧化铝与Fe,该反应为铝热反应,放出大量的热;
(4)工业上制备Si,用碳与二氧化硅反应生成Si与CO,硅是良好的半导体材料、可以用作太阳能电池等
解答 解:短周期元素A、B、C、D、E位于同周期且原子序数依次增大.A、C、E三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化物之间两两皆能反应,均生成盐和水,为氢氧化铝与强碱、强酸的反应,故A为Na、C为Al,B为Mg元素,E原子最外层电子数为10-1-3=6,则E为硫元素;D原子最外层的电子数是次外层的一半,处于第三周期,最外层电子数为4,故D为Si.
(1)金属性Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:NaOH>Mg(OH)2>Al(OH)3,故答案为:NaOH;
(2)E为硫元素,原子有3个电子层,最外层电子数为6,处于周期表第三周期第ⅥA族,故答案为:三;ⅥA;
(3)Al与氧化铁在高温下反应生成氧化铝与Fe,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(4)工业上用碳与二氧化硅反应制备硅,反应生成Si与CO,反应方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,硅是良好的半导体材料、可以用作太阳能电池等,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;半导体材料、太阳能电池.
点评 本题考查结构性质位置关系应用等,难度不大,推断元素是解题的关键,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题

 ;写出聚乙烯的一种用途食品包装袋.
;写出聚乙烯的一种用途食品包装袋.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
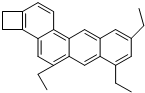 如图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为doggycene,有关doggycene的说法不正确的是( )
如图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为doggycene,有关doggycene的说法不正确的是( )| A. | 该分子中所有碳原子可能处于同一平面 | |
| B. | doggycene的分子式为C26H26 | |
| C. | 1mol该物质在氧气中完全燃烧生成CO2和水的物质的量之比为2:1 | |
| D. | 该物质常温下为气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用硫化亚铁固体和稀硫酸制备硫化氢 | |
| B. | 用亚硫酸钠固体与浓硫酸制备二氧化硫 | |
| C. | 用碳酸钙固体与稀硫酸制备二氧化碳 | |
| D. | 用生石灰与浓氨水制备氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 性质或结构信息 |
| B | 原子最外层电子数是电子层数的3倍. |
| C | 工业上通过分离液态空气获得其单质.原子的最外层电子数是内层电子总数的2.5倍. |
| D | 单质是黄色晶体,不溶于水,微溶于酒精,易溶于二硫化碳,游离态的D存在于火山喷口附近或地壳的岩层里. |
| E | 最高价氧化物的水化物能电离出与Ne电子数相等的阴阳离子. |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

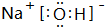 ,其晶体类型为离子晶体.
,其晶体类型为离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溶液稀释到原体积的10倍 | B. | 加入适量的醋酸钠固体 | ||
| C. | 加入等体积0.2mol/L盐酸 | D. | 提高溶液的温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com