
【题目】科学家合成出了一种新化合物(如图所示),其中M、W、T、L为同一短周期元素,L核外最外层电子数是W核外电子数的一半。下列叙述正确的是
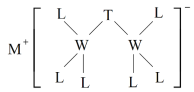
A.化合物ML属于离子化合物,也属于弱电解质
B.该新化合物中T满足8电子稳定结构
C.W的最高价氧化物可以与水反应生成弱酸
D.元素非金属性的顺序为W>T>L
【答案】B
【解析】
M、W、T、L为同一短周期元素,根据图知,W能形成4个共价键、L能形成1个共价键,则W位于第IVA族、L位于第VIIA族,且L核外最外层电子数是W核外电子数的一半,L最外层7个电子,则W原子核外有14个电子,故W为Si元素,L为Cl元素;该阴离子中Cl元素为﹣1价、W元素为+4价,根据化合价的代数和为﹣1价可知,T为﹣3价,所以T为P元素;根据阳离子所带电荷知,M为Na元素,据此解答。
通过以上分析知:M、W、T、L分别为Na、Si、P、Cl元素。
A.NaCl为离子化合物,但属于强电解质,故A错误;
B.结合分析可知,该化合物中P为﹣3价,P原子最外层电子数为5+3=8,满足8电子稳定结构,故B正确;
C.Si的最高价氧化物为SiO2,SiO2不与水反应,故C错误;
D.同一周期元素非金属性随着原子序数增大而增强,则非金属性Cl>P>Si,即非金属性:L>T>W,故D错误;
故答案为B。


科目:高中化学 来源: 题型:
【题目】按要求写出下列方程式
(1)铝热反应冶炼金属铁的化学方程式:___。
(2)工业冶炼金属铝的化学方程式:___。
(3)铝片打磨后与氢氧化钠溶液反应的离子方程式:___。
(4)四氧化三铁与稀硝酸反应的离子方程式:___。
(5)向NH4Al(SO4)2溶液中滴加氢氧化钡溶液使SO![]() 恰好完全沉淀,写出反应的离子方程式:___。
恰好完全沉淀,写出反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式为![]() ,下列叙述不正确的是( )
,下列叙述不正确的是( )
A.1mol该有机物在加热和催化剂作用下,最多能和4molH2反应
B.该有机物能使溴水褪色,也能使酸性KMnO4溶液褪色
C.该有机物在一定条件下能发生消去反应或取代反应
D.该有机物遇硝酸银溶液产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化原理为2NO(g)+2CO(g)N2(g)+2CO2(g)ΔH=-746.5kJ·mol-1,如图为在不同初始浓度的CO和不同催化剂Ⅰ、Ⅱ作用下(其他条件相同),体积为2L的密闭容器中n(N2)随反应时间的变化曲线,下列说法正确的是( )
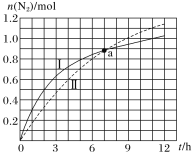
A.a点时,催化剂Ⅰ、Ⅱ作用下CO的转化率相等
B.0~6h内,催化剂Ⅰ的催化效果比催化剂Ⅱ的好
C.0~5h内,催化剂Ⅰ作用下CO的反应速率为0.32mol·L-1·h-1
D.0~12h内,催化剂Ⅱ作用下反应放出的热量比催化剂Ⅰ的多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应的实验,能达到实验目的的是
A.  所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
B.  所示装置验证二氧化硫的漂白性
所示装置验证二氧化硫的漂白性
C.  所示装置分离四氯化碳和苯的混合物
所示装置分离四氯化碳和苯的混合物
D.  所示装置检验氯化铵受热分解生成的两种气体
所示装置检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法错误的是 ( )
A.疫苗一般应冷藏存放,以避免蛋白质变性
B.医用口罩无纺布的原材料成分之一是聚丙烯,其结构简式为![]()
C.使用医用酒精杀菌消毒的过程中只发生了物理变化
D.医用防护服的核心材料是微孔聚四氟乙烯薄膜,其单体四氟乙烯属于卤代烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究外界条件对反应:mA(g)+nB(g)cZ(g) ΔH 的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是 ( )
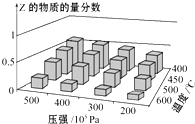
A.在恒温恒压条件下,向已达到平衡的体系中加入少量Z,达新平衡时,Z的物质的量分数不变
B.升高温度,正、逆反应速率都增大,平衡常数增大
C.ΔH>0,m+n>c
D.温度不变,增大压强,平衡正向移动,达新平衡时,A的浓度比原平衡减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com