
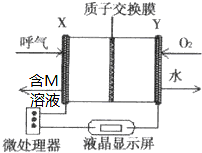
 查处酒后驾驶所采用的“便携式乙醇测量仪”,以燃料电池为工作原理,如图,两电极材料均为Pt.理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为M,其中一个电极的反应式为:CH3CH2OH-2e-→M+2H+.下列说法中正确的是( )
查处酒后驾驶所采用的“便携式乙醇测量仪”,以燃料电池为工作原理,如图,两电极材料均为Pt.理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为M,其中一个电极的反应式为:CH3CH2OH-2e-→M+2H+.下列说法中正确的是( )| A. | 电池内部H+向X极移动 | |
| B. | 另一极Y极的电极反应式为:O2+4e-+2H2O=4OH- | |
| C. | 乙醇在X极上发生还原反应,电子经过外电路流向Y极 | |
| D. | 电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O |
分析 有质子交换膜,氢离子能够移向正极,乙醇被氧化,则X为负极反应,正极上氧气得电子和氢离子反应生成水,Y极电极反应式为O2+4e-+4H+=2H2O,电池总反应与乙醇催化氧化的方程式相同,应为2CH3CH2OH+O2→2CH3CHO+2H2O,原电池放电时,阳离子向正极移动,电子从负极沿导线流向正极,据此分析.
解答 解:A、放电时,电解质溶液中氢离子向正极移动Y,故A错误;
B、存在质子交换膜,氢离子能够移向正极,正极上氧气得电子和氢离子反应生成水,Y极电极反应式为O2+4e-+4H+=2H2O,故B错误;
C、乙醇被氧化,发生氧化反应,故C错误;
D、电池总反应与乙醇催化氧化的方程式相同,应为2CH3CH2OH+O2→2CH3CHO+2H2O,故D正确;
故选D.
点评 本题考查了原电池原理,根据正负极上发生的电极反应及电子、电解质溶液中阴阳离子移动方向来分析解答即可,易错选项是B,写电极反应式时要注意结合溶液的酸碱性,在酸性溶液,生成物中不能有氢氧根离子生成,在碱性溶液中,生成物中不能有氢离子生成.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:解答题
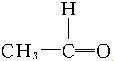 +
+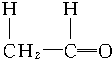 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$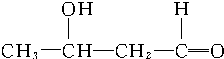
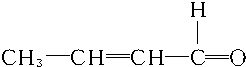 +2H2$→_{△}^{催化剂}$
+2H2$→_{△}^{催化剂}$
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
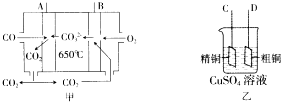 一氧化碳是一种用途十分广泛的化工基础原料.
一氧化碳是一种用途十分广泛的化工基础原料.| 温度 | 250℃ | 300℃ | 350℃ |
| A | 2.041 | 0.250 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1:V2的值 | B. | V1和V2的值 | ||
| C. | X和Y的物质的量 | D. | 盐酸和稀硫酸的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
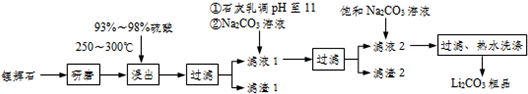
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2CO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基-1-丁烯 | B. | 2,3-二甲基-2-乙基丁烷 | ||
| C. | 3,3,5,5-四甲基己烷 | D. | 2-甲基-1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b L | B. | (b-a)L | C. | (2a-b)L | D. | (2b-a)L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com