
| A.纸上层析法通常以滤纸作为惰性支持物。滤纸纤维上的羟基具有亲水性,它所吸附的水作固定相 |
| B.重结晶时,溶质的溶解度越大、溶液冷却速度越慢,得到的晶体颗粒越大 |
| C.往海带灰的浸泡液中加入过量的氯水,以保证I-完全氧化为I2 |
| D.将3~4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 |
科目:高中化学 来源:不详 题型:单选题
| A.取少量待测溶液先加入BaCl2溶液,再加入足量的盐酸,有白色沉淀且不溶于盐酸,则该溶液中一定含有大量的SO42- |
| B.某无色溶液滴加氯水和CCl4,振荡、静置分层后,下层溶液显橙红色,则原溶液中有I- |
| C.用铂丝蘸取少量溶液进行焰色反应,火焰呈黄色,则该溶液一定是钠盐溶液 |
| D.取少量待测溶液滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 物质 | 杂质 | 试剂 | 方法 |
| A | 苯 | 苯酚 | 溴水 | 过滤 |
| B | 二氧化碳 | 二氧化硫 | 澄清石灰水 | 洗气 |
| C | 氧化铁 | 二氧化硅 | 氢氧化钠溶液 | 过滤 |
| D | 乙酸乙酯 | 乙酸 | 饱和碳酸钠溶液 | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用过滤的方法分离溶液和胶体 | B.用蒸馏的方法将自来水制成蒸馏水 |
| C.用四氯化碳萃取碘水中的碘 | D.用加热的方法分离氯化钠和氯化铵固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
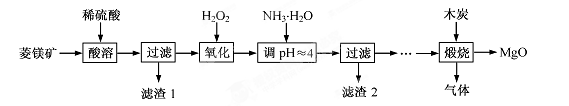
 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑ MgO+SO2↑+CO↑
MgO+SO2↑+CO↑ MgO+S↑+3CO↑
MgO+S↑+3CO↑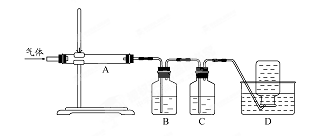
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
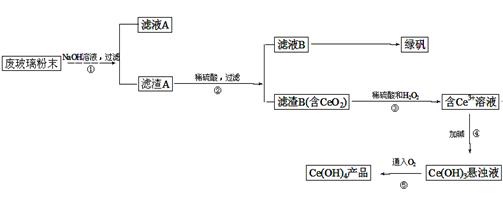
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
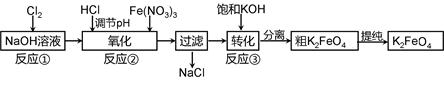
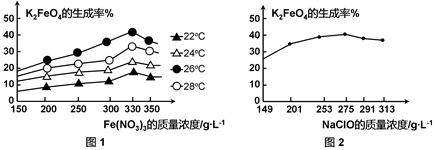
 4Fe(OH)3 + 8OH- + 3O2。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。
4Fe(OH)3 + 8OH- + 3O2。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。| A.H2O | B.CH3COONa、异丙醇 | C.NH4Cl、异丙醇 | D.Fe(NO3)3、异丙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com